PBMC重建是目前常见的免疫重建方式,可以较快的在免疫缺陷鼠中将人的T细胞重建,相对于CD34+造血干细胞重建模型,实验周期更短,可用于多种模型开发或药效评价,如GvHD模型、过继性细胞治疗、溶瘤病毒以及免疫检查点药物特别是T细胞相关药物的药效评价。但在实际实验中,变量较多,实验重复性较差,如何在不确定因素中建立相对稳定的实验条件是PBMC重建的关键因素。
百奥赛图通过PBMC的donor筛选、细胞系敏感性和接种时间筛选,尽量减少实验中的变量,力求提高实验稳定性,在不确定性中寻找确定性,可为您提供全套的PBMC重建实验方案。

图1 PBMC重建和药效流程图
招式一:Donor筛选
不同donor对NDG小鼠上的攻击性有较大差别,如下图所示,3个donor重建后观察体重、体重变化、GvHD评分和生存曲线,可以看到不同donor的反应差别很大,反应太严重的无法满足我们实验的时间窗口,我们选择那些GvHD评分评分适中,体重下降不明显的建立自己的donor库,再进行后续的其他筛选实验。
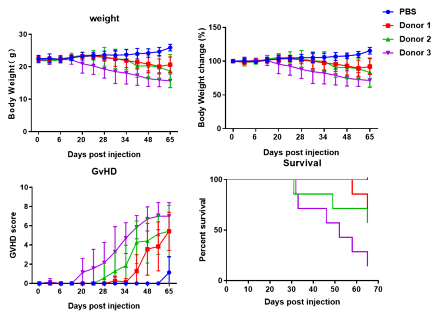
图 2 用不同donor免疫重建对NDG小鼠的影响
在筛选到稳定来源donor后,就可以进行CDX或PDX的成瘤,不同细胞系或肿瘤块在不同PBMC上的敏感性不同,此处以细胞系举例说明其筛选过程。
招式二:不敏感细胞系筛选
因为不同donor在不同细胞系上的敏感性不同,因此在我们选定donor后就需要对细胞系进行成瘤,筛选出那些可以在对应donor上长起来的细胞系,根本原因是不同来源的PBMC和细胞系HLA分型不同,导致PBMC本身对细胞系有一定的杀伤,不同donor对同一个细胞系反应会有不同,同一个donor对不同细胞系的反应也可能不同。
例如,我们选用不同的donor在Raji和A375细胞系上进行成瘤,使用不同donor重建后移植同样数量的A375细胞系,有的细胞可长起来,有的就长不起来,因此,针对donor 1,我们可以进行后续的A375的药效实验,donor 2则无法进行此类实验,只能使用其他细胞系进行药效验证。
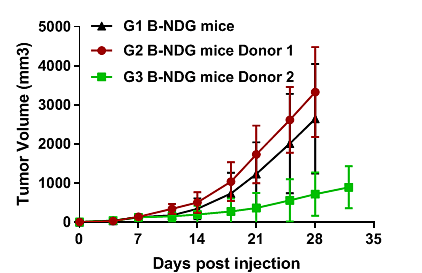
图3 不同Donor在A375细胞系的敏感性不同
招式三:接种时间的选择
一般来说,在PBMC重建进行药效试验分组时会有2个分组标准:CD45的比例和肿瘤体积,经查阅大量文献,当CD45比例达到10%左右,实体瘤肿瘤细胞系达到100±50mm3时,2个标准同时达到后我们才会进行分组给药,为了使两个时间点正好能够重合,我们需要摸索PBMC和细胞系的接种时间,一般而言会固定PBMC接种时间后再接种细胞系,百奥赛图根据前面确定的donor和细胞系,已经摸索了近20种细胞系接种时间,可以直接拿来进行后续的药效筛选。
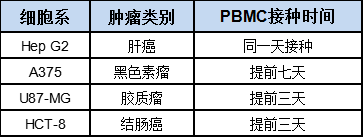
通过这三招筛选,百奥赛图已经建立了自己的donor库和成瘤细胞系库,并且摸索出了不同细胞系的接种时间,同时我们也在不断筛选新的donor,扩大自己的库存,以满足后续大量的药效筛选需求。
想要了解更多人免疫系统重建模型相关知识吗?您还可以进入公开课模块点击《人免疫系统重建模型的构建和应用》进行系统学习,后续我们也会出一系列干货文章,请持续关注,如您在实验过程中遇到其他棘手问题,欢迎留言咨询我们。
参考文献:
1. Guil-Luna, S., Sedlik, C. & Piaggio, E. Humanized Mouse Models to Evaluate Cancer Immunotherapeutics. Annual Review of Cancer Biology 5, 119-136 (2021).
2. De La Rochere, P., et al. Humanized Mice for the Study of Immuno-Oncology. Trends in immunology 39, 748-763 (2018).
3. Varadé, J., Magadán, S. & González-Fernández, Á. Human immunology and immunotherapy: main achievements and challenges. Cellular & molecular immunology 18, 805-828 (2021).
撰稿:赵可






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号