我们的胚胎冷冻3年了,会不会冻坏了呀,会不会对宝宝有伤害呀?
冷冻胚胎解冻后,会不会失败呀?
冷冻胚胎的成功率,会不会比新鲜胚胎差呀?
关于胚胎冷冻,相信不少朋友都会有这样的疑问,那胚胎冷冻究竟是怎么一回事呢?

胚胎冷冻复苏简介
01、胚胎冷冻的原理
低温能降低细胞新陈代谢水平,抑制细胞生命活动,处于超低温下的细胞,其新陈代谢几乎完全停止,使细胞能够被长期保存。胚胎冷冻通过特殊的保护措施和降温程序将胚胎存放在超低温环境中,而复温后又恢复代谢能力,从而达到维持胚胎原有生物活性,长期保存胚胎的目的。
目前,最常用的低温环境为液氮,保存温度为-196℃。常用的小鼠冷冻方法是玻璃化冷冻[1]。
02、玻璃化冷冻的定义
玻璃化是指在快速的降温过程中,液体粘性会急剧上升并且转变成一种玻璃状的非晶体状态。玻璃化的优点在于不会改变分子的无序状及原有的结构顺序,且无冰晶产生。对胚胎进行玻璃化冷冻操作首先要将其暴露于高浓度的冷冻保护剂中进行快速脱水皱缩,待其完全脱水后再置于冷冻载体上,最后直接投入液氮中迅速降温。胚胎在液氮中处于静止状态,可以长期保存。待到再次使用时,可以使用冷冻保护剂进行胚胎复苏,逐步稀释胚胎内部及表面的冷冻保护剂,最终使胚胎恢复到正常生理状态[2]。
03、冷冻胚胎的复苏
胚胎的解冻与冷冻相反,是将胚胎从超低温状态下恢复至正常生理状态的过程。解冻主要有两个过程,一个是复温,一个是去除冷冻保护剂,最终达到恢复胚胎生理活性及继续发育的目的。
复温一般采用较快的升温速度,避免在中间产生一些冰晶对胚胎造成损伤,胚胎冷冻时,胚胎中渗透了高浓度的冷冻保护剂,复温后需及时将其去除,使水分能替代保护剂渗入细胞内,因此解冻剂中含有一些非渗透性保护剂,胚胎可逐步吸收水分,并将冷冻剂从胚胎细胞中渗出,且不会因水分吸收过快而导致细胞膜内外渗透压剧烈变化,对胚胎造成损伤。
胚胎解冻时选择何种方法需依据胚胎冷冻时选择的方法,不同的冷冻方法不仅冷冻原理有差别,且胚胎装载的方式也完全不同,因此解冻时也需采用不同的解冻方法和程序,解冻方法需与冷冻时的方法相对应,这样更有利于胚胎的复苏及生理功能的恢复,不恰当的复苏方法会对胚胎造成较大的损伤。
04、胚胎冷冻保护剂
冷冻保护剂可分为渗透性和非渗透性两种。
渗透性冷冻保护剂又称细胞内冷冻保护剂,渗透性冷冻保护剂对细胞有不同程度的毒性作用,能影响细胞的微管和微丝的组成和功能,主要有乙二醇(ethylene glycol,EG)、丙二醇(1,2-propenadiol,PG)、二甲基亚砜(dimethylsulfoxide,DMSO或Me2SO)、丙三醇(又称甘油glycerol,GL)、乙酰胺(AA)等。
非渗透性冷冻保护剂又称细胞外冷冻保护剂,均为大分子聚合物,在细胞膜完整的情况下,不能自由扩散透过细胞膜,作为渗透缓冲剂能提高细胞外液的渗透压,控制水进入细胞的速度,减少解冻复温时引起的渗透休克,从而避免造成细胞破裂和细胞肿胀,主要有蔗糖(sucrose)、葡聚糖(dextran)、聚蔗糖(ficoll)等。
将两种冷冻保护剂联合应用,既能促进玻璃化过程,又提高冷冻效率,能减少两者的用量,从而减轻高浓度的冷冻保护剂的细胞毒性作用。
胚胎冷冻复苏操作
01、胚胎DAP玻璃化冷冻操作
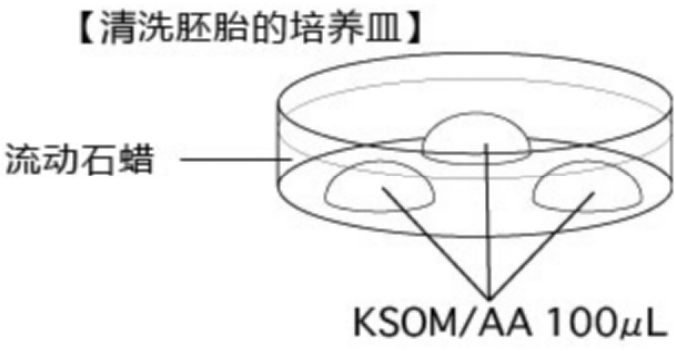
过滤1M DMSO后,在培养皿上滴入4个滴液(~100µL/个)。其中一滴用于清洗从培养基里采集的胚胎,其余三个用于存放已清洗的胚胎。
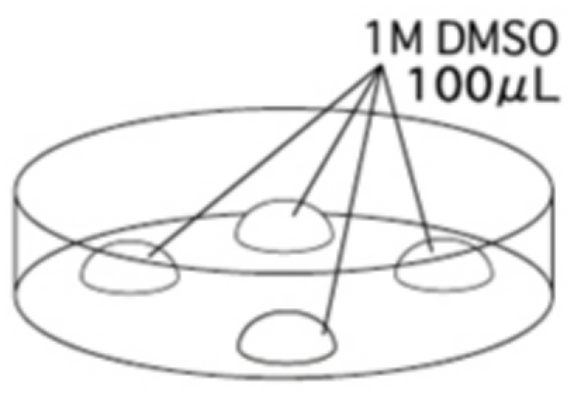
把全部胚胎放入其中一个滴液里,清洗沾有培养基的胚胎。清洗后的胚胎平均放进其余的3个滴液里。这3个等份的胚胎最终将会转移至储存小瓶里。
例如,采集了120个胚胎,分成3个等份,每一等份40个,这些胚胎首先会一起放到清洗的滴液里,然后再分成3份放进3个滴液里。
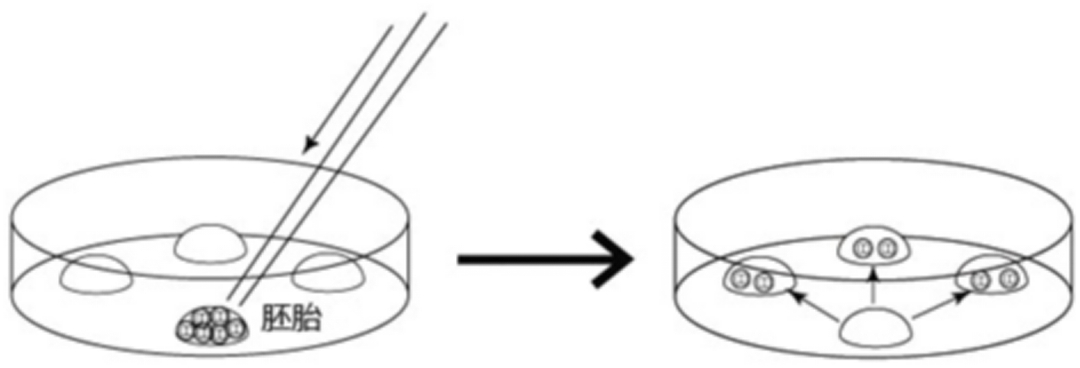
使用20µL移液管和灌注凝胶枪头,转移5µL的1M DMSO溶液的胚胎至冻存管内。转移后,立即将冻存管放置0℃冷却器内5分钟。
注意:冻存管可以放在0℃冷却器中超过5分钟(<20分钟)。
注意:如果胚胎都集中在滴液的中央,就能把全部胚胎轻易地吸进5µL的1M DMSO溶液中。
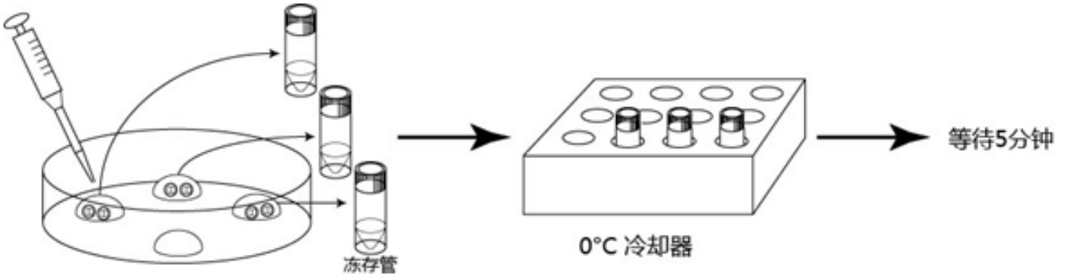
在0℃下,往冻存管里加入45µL的冻存液(DAP213),并在在0℃冷却器里静置5分钟。
注意:加入DAP213冻存液后,不要把低温管的塞子拧得太紧,否则胚胎复苏后很难快速转移。

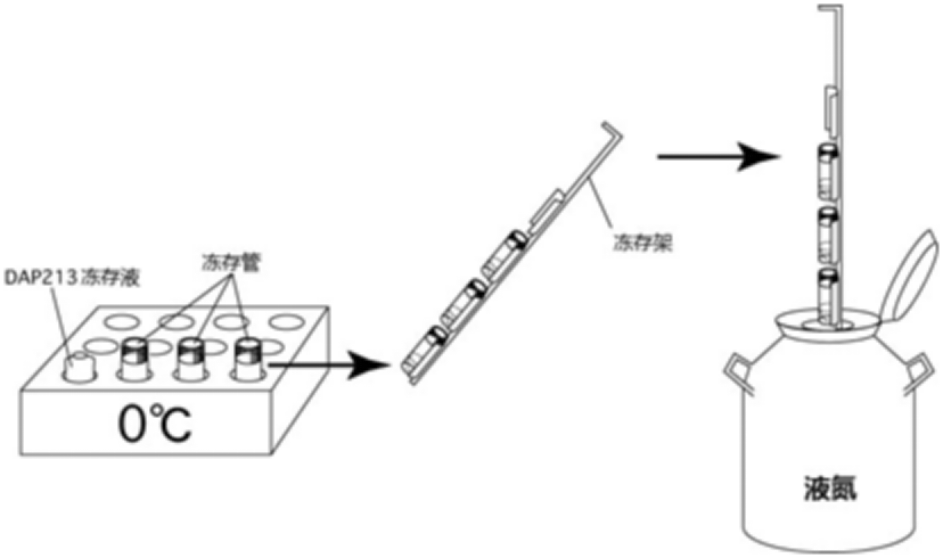
迅速将冻存管放到冻存架上,然后直接放进液氮里[3]。
02、胚胎玻璃化冷冻后的复苏
准备清洗胚胎用的培养皿和蔗糖溶液
首先制作清洗复苏后胚胎的培养皿,静置在CO2培养箱内30分钟以上,稳定内部气体。
预先在CO2培养箱内加热0.25M蔗糖溶液。
胚胎的复苏
从液氮储存器内取出冻存的EP管后,立刻打开盖子,倒掉EP管内的液氮,在室温下静置30秒。
用自动移液器把0.9mL已预热到37℃的0.25M蔗糖溶液添加进EP管内,在蔗糖溶液完全溶进冻存液前要迅速移液(10次左右)。
融解后的冻存液在常温下细胞毒性很强,因此需要迅速往EP管内添加0.25M蔗糖稀释冻存液。
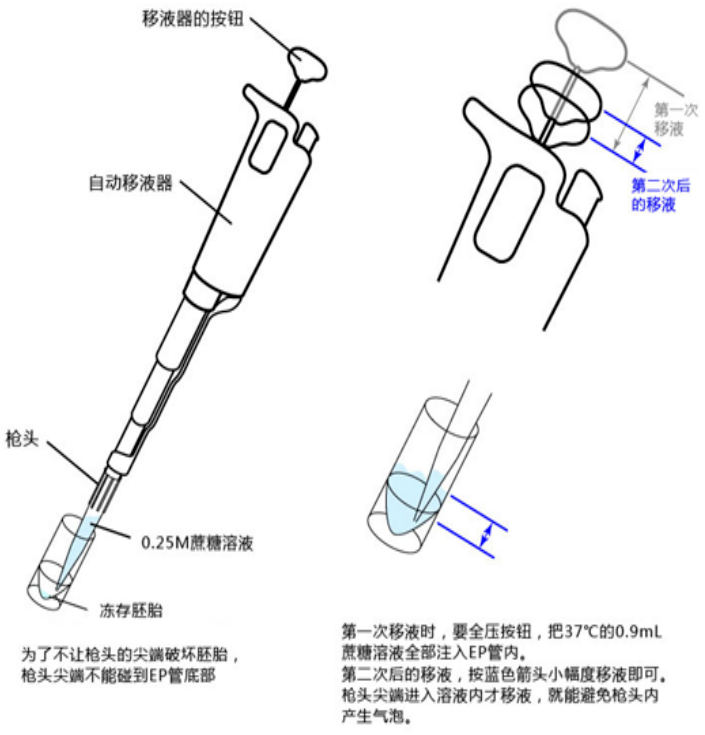
移液
如下图所示,首次移液需迅速把0.9mL 0.25M蔗糖溶液转移至EP管内加热(请注意如果枪头的尖端接触冻存液,枪头内的蔗糖溶液会冻结并阻塞在枪头的尖端)。
第二次以后的移液,就按照下图蓝色箭头所示小幅度移液。此外,第二次以后的移液,以免损坏胚胎,应小心且迅速有序地移液加热胚胎。
使用自动给移液器,将冻存液和蔗糖溶液的混合溶液移至培养皿上,接着用0.4~0.5mL的0.25M蔗糖溶液清洗EP管。
注意:移液时,尽量避免产生气泡。在混合溶液移至培养皿上时,如果溶液表面产生气泡,气泡会阻碍取回胚胎,此时可用酒精灯加热解剖针的尖端,然后刺破气泡。
胚胎复苏时移液要点:请注意,移液过程中如果枪头内有气泡,混合溶液移至在培养皿后,溶液表面产生的大量气泡会导致难以在显微镜下观察胚胎,无法取回胚胎。
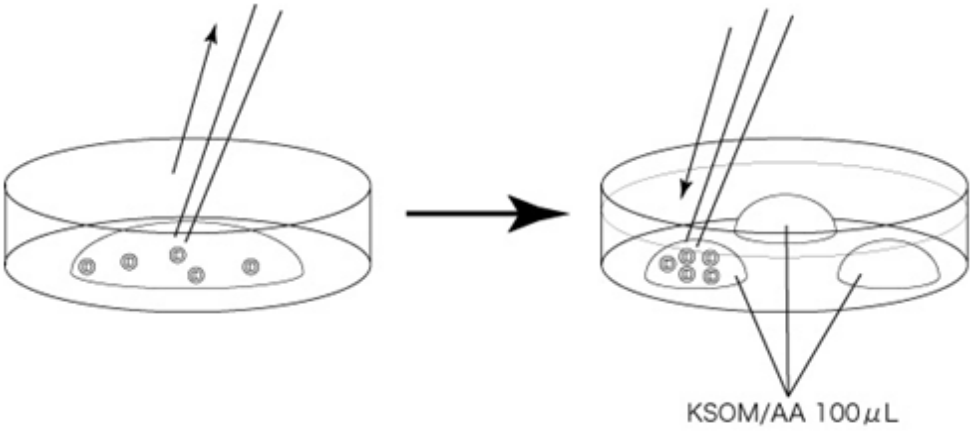
直接从混合溶液里取出胚胎,小心地导入预先制作好(清洗前30分钟以上开始准备)、清洗胚胎的培养皿上的KSOM/AA滴液里,静置在培养箱内10分钟。
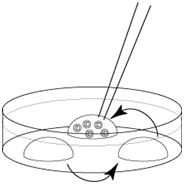
静置10分钟后

用剩下的KSOM/AA滴液清洗胚胎两遍[4]。
03、胚胎EFS玻璃化冷冻及复苏
冷冻方法:2-cell在EFS20中平衡2min,移入0℃的EFS40中,计时1min后置于液氮中保存。
复苏方法:将胚胎从液氮中取出,倒掉液氮,计时30s,加入0.75M蔗糖反复吹打,再转入0.25M蔗糖液滴中,清洗3次,在KSOM中清洗3遍,移入KSOM中37℃培养10min后即可移植[5]。
参考资料
1. 《小鼠胚胎操作实验手册》(原著第三版).
2. 陈雨荣, 玻璃化冷冻对小鼠胚胎发育的影响及机制研究. 2023.
3. http://jinpanbio.com/archives/50319
4. http://jinpanbio.com/archives/50341
5. 王俊风,李淼,张艺宝,郁丽丽,魏勤,刘丽均,施美莲,徐平, 两种玻璃化胚胎冷冻方法对不同品系小鼠胚胎冷冻效果比较. 2013.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号