共济失调是一种由于肌肉控制能力下降引发的笨拙和非自主的运动。患者的行走和平衡、手部协调、语言表达以及吞咽和眼睛移动的能力都可能受到影响。
通常情况下,共济失调是由于负责控制肌肉协调的脑组织(小脑)或其连接部位受到损伤所引起的。许多因素可导致共济失调,包括酒精滥用、中风、肿瘤、大脑退化、多发性硬化症、药物毒性以及遗传性疾病[1]。
弗雷德里希共济失调
弗雷德里希共济失调(FRDA)是一种最常见的早发型常染色体隐性共济失调。作为一种全身性疾病,除了主要的神经系统症状如步态不稳、四肢协调能力丧失、言语困难、听力损失等,患者还可能发展出心肌增厚型心肌病,以及I、II型糖尿病等病症。通常,FRDA的发病年龄在5岁至20岁之间,随着疾病的进展,多数患者在发病后15-20依赖轮椅辅助生活[2]。
这种疾病是由编码蛋白质Frataxin(FXN)的基因的隐性突变引起的:正常等位基因第一个内含子具有少于33个GAA重复,而96% 的 FRDA 患者是异常 GAA 扩展 66-1500 重复的纯合子,另有4% 的患者在一个 FXN 等位基因上存在点突变或缺失,并且另一个等位基因上存在扩展。通常来讲,GAA 扩展长度越长(特别是两个等位基因中较短的那个),Frataxin蛋白的表达降低越多,临床严重程度也越大[2,3]。
Frataxin蛋白主要位于线粒体中,参与了Fe-S团簇的合成、维护和修复, 在铁代谢中起着重要作用,是维持氧化磷酸化、三羧酸循环等其他细胞功能必不可少的一员。尽管FRDA的致病机理还待更完善的研究,但现有研究表明Frataxin缺乏的细胞和组织表现出氧化应激反应,线粒体铁积累,ATP产生减少和细胞功能障碍。这些因素可能导致信号传导减少和DNA转录的调控,造成蛋白质表达改变,进而引起组织损伤、免疫反应改变,最终体现在临床病理学表现上 (图1)。最易受影响的组织包括脊神经后根节神经元、小脑齿状核、运动神经元、心肌细胞、胰岛素分泌细胞以及大脑和视网膜等[2,4]。
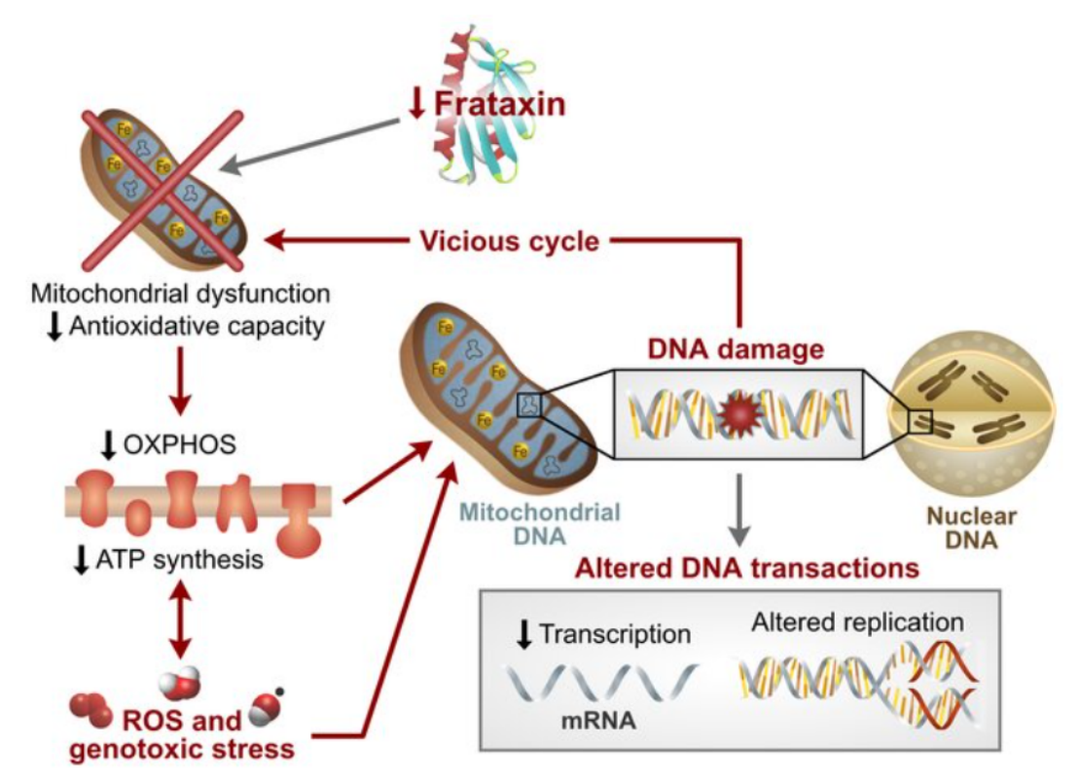
图1. FRDA 的致病机制[4]
相关药物开发
在很长一段时间内, FRDA都是一种无药可治的疾病。数十年的研究中,科学家们尝试过多种药物,例如使用铁鳌合剂减少细胞中的铁沉积,抑或利用抗氧化剂例如维生素E、辅酶Q10等减轻氧化防御的损害,但都没有取得令人满意的结果。直至最近,研究者们确定了两个药物开发方向,并取得了一些成果,为治疗FRDA带来了一线曙光[2]。
01.基因疗法
通过基因疗法,蛋白质替代,表观遗传学治疗等方法直接逆转frataxin缺乏。鉴于FRDA的主要原因是先天性活性frataxin缺乏,导致线粒体功能障碍,理论上,如果能在足够早的时间、足够多的细胞中以足够程度持续恢复frataxin,则可以有效改善疾病。
许多临床前研究证实了这个方法的可行性,例如,在FRDA小鼠模型中,使用HDAC抑制剂对FXN进行表观遗传激活可增加frataxin水平并逆转行为缺陷[5,6]。
但是在临床中,确认剂量,合理的递送方法确保药物在组织的渗透,以及干预时机等仍有很大挑战。例如,由于frataxin在多种组织中分布,可能需要多种AAV载体来传递FXN基因,也很难靶向大脑[5,6];初次治疗后产生的免疫反应让重复给药困难重重[7];转导数量不足和细胞表达frataxin水平过高产生毒性之间的平衡也很难把控[8]。更多的基础研究和方法优化可能在未来给此种疗法带来更多希望。
02.改善致病下游事件
除了逆转frataxin缺乏,另外一个药物开发思路是改善致病的下游事件。研究表明,frataxin的缺乏会导致Nrf2信号传导受损。正常情况下,NRF2可转移至核内,诱导多个分子通路的转录因子,这些分子通路能够通过恢复线粒体功能、降低氧化应激、抑制促炎信号而减轻炎症反应。而在FRDA患者的细胞和组织中,面对氧化剂,NRF2的激活程度降低,不进入细胞核内,增加NRF2的水平和激活程度则可逆转这些事件。
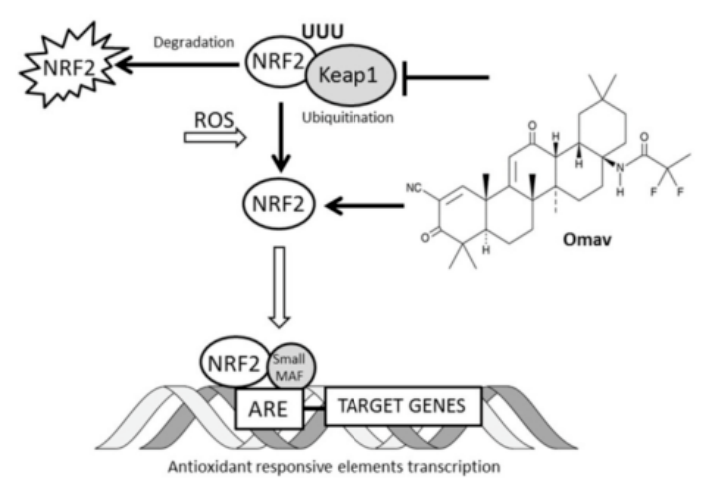
图2. Omaveloxolone 的作用机制[9]
基于这个机制,Reata Pharmaceuticals公司的研究人员开发出了Nrf2激动剂omaveloxolone(图2),并在两种FRDA小鼠模型和病人成纤维细胞中验证了有益效果[9]。Omaveloxolone在美国、欧洲和澳大利亚的11个机构进行了国际双盲随机对照并行注册阶段2试验(NCT02255435, EudraCT2015-002762-23):约100名16到40岁的患者被1:1随机分配接受安慰剂或每天150mg omaveloxolone,通过共济失调神经系统评定量表(mFARS)来评估FA的疾病进展情况。48周时,omaveloxolone给药组的mFARS评分显著改善,达到了实验的主要终点,并且安全耐受良好。在2023年2月,Omaveloxolone(商品名SKYCLARYS™)已经获得FDA批准上市,成为第一个FRDA药物。
Omaveloxolone的成功无疑给困难重重的神经退行性疾病药物开发打了一剂强心针。未来,针对不同作用机制开发的更多FRDA药物将更好的造福患者。
临床前研究服务
根据市场需求和研发热点,百奥动物提供多种临床前服务评估CNS疾病药物药效:
01.小鼠运动协调能力的行为学评估
转棒实验
用于评估啮齿类动物的运动协调、平衡、疲劳程度等。试验时,将小鼠放置于杆上,动物必须在旋转的杆上保持平衡。杆可以设置,初始转速,加速度,最终转速等。最终,根据动物在转棒上掉落的时间,掉落时速度,掉落时运动路程,动物的掉落方式等评价动物的运动协调能力。
训练对转棒实验结果的影响
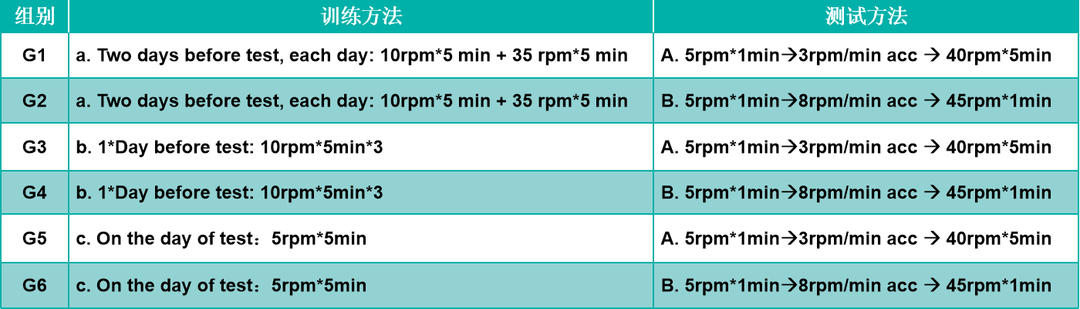
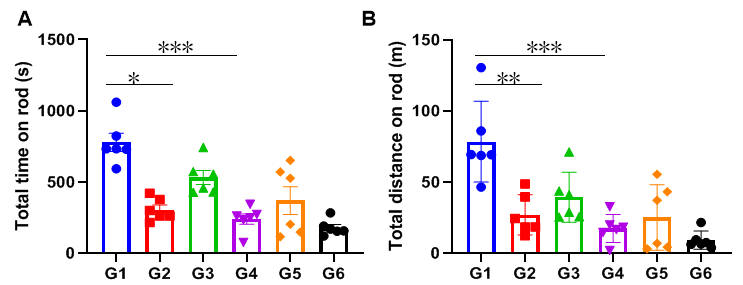
(A)在杆上运动总时间;(B)在杆上运动总距离。
基于轻度EAE模型的转棒实验
实验动物:C57BL/6J,8-9周,雌性
实验分组:
G1-PBS;
G2-CFA自制;
G3-commercial CFA
EAE模型:MOG乳剂诱导轻度实验性自身免疫性脑脊髓炎模型
训练方法:
b.测试前一天:10rpm*5min*3 (D21)
测试方法:
A.5rpm*1min→3rpm/min→40rpm*5min (AT D22)
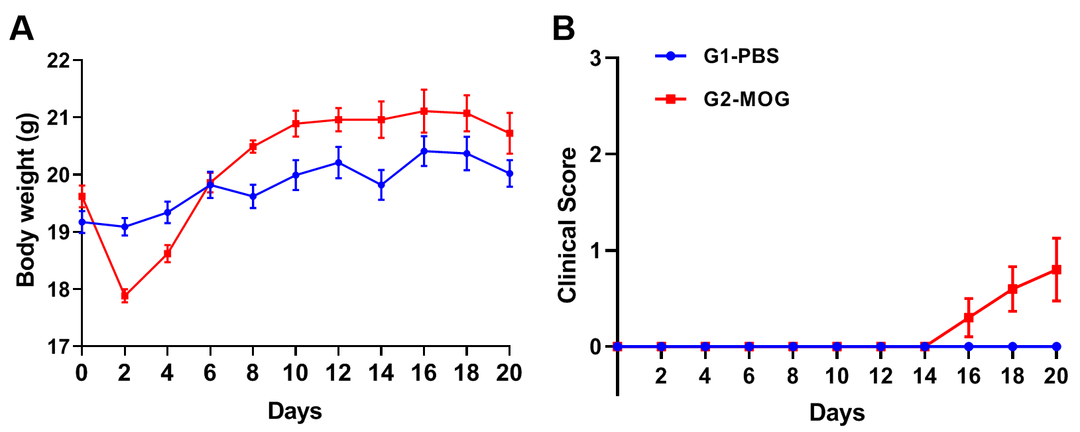
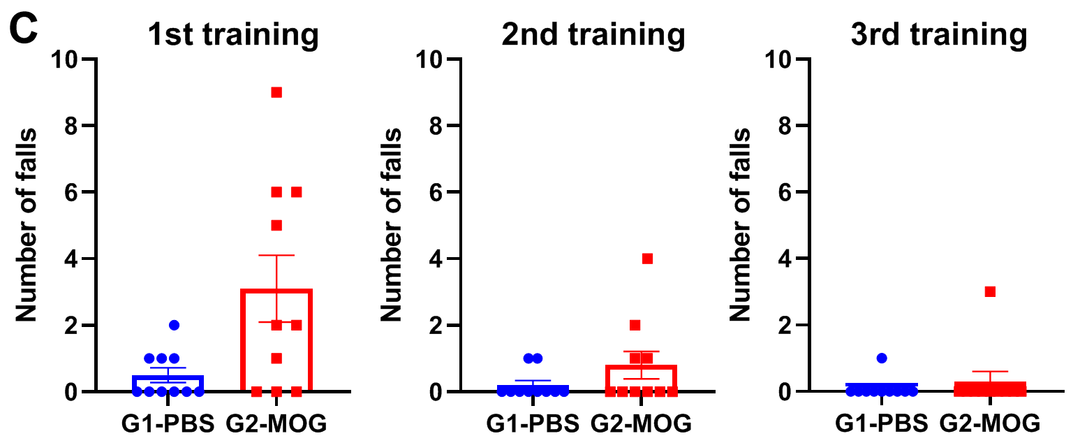
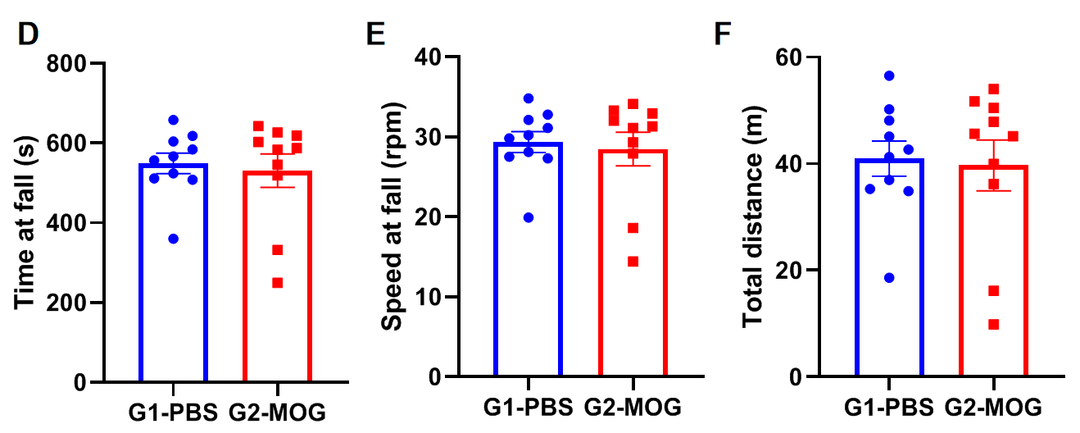
(A)体重;(B)临床评分;(C)每轮训练中掉落次数;(D)掉落潜伏时间;(E)掉落时速度;(F)总行进距离。
对麻醉动物进行转棒实验
实验动物:C57BL/6J, 7-8周,雌性
实验分组:
G1-15mg/kg Zoletil®50+1.5mg/kg Xylazine hydrochloride;
G2-7.5mg/kg Zoletil®50+0.75mg/kg Xylazine hydrochloride;
G3-3.75mg/kg Zoletil®50 +0.375mg/kg Xylazine hydrochloride;
G4-control;
训练方法:
b.测试前一天:10rpm*5min*3
测试方法:
A.5rpm*1min→3rpm/min acc→40rpm*5min
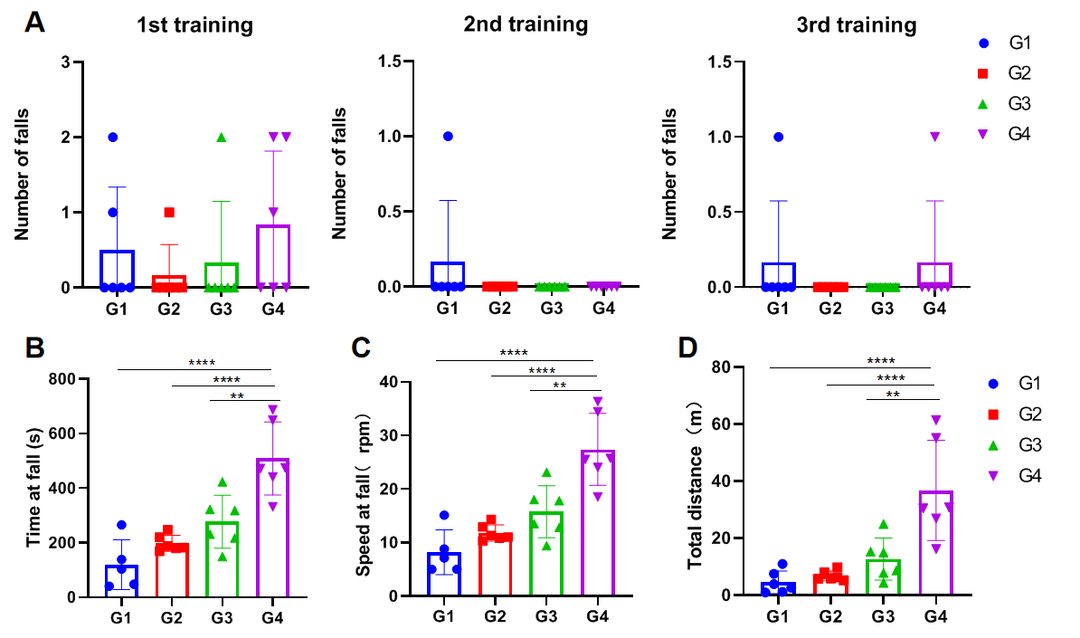
(A)每轮训练中掉落次数;(B)掉落潜伏时间;(C)掉落时速度;(D)总行进距离。
旷场实验
旷场实验和其延伸实验可用于评价实验动物的运动能力、在新异环境中自主行为、焦虑程度和记忆学习能力等。在实验中,将动物放入旷场中的特定位置,用摄像系统来监测动物在旷场中的活动情况,通过视频记录分析软件来进行动物的轨迹追踪和数据采集分析。根据运动时长,运动距离,运动速度,在各区域停留时间,区域间穿越次数,排便情况,探索行为次数等对动物进行评价。

图3. 旷场实验
基于EAE模型进行旷场实验
实验动物:C57BL/6J,8-9w,雌性
EAE模型:MOG乳剂诱导轻度实验性自身免疫性脑脊髓炎模型
实验分组:
G1-PBS;
G2-CFA自制;
G3-commercial CFA
试验方案:10分钟自由探测(AT D21)
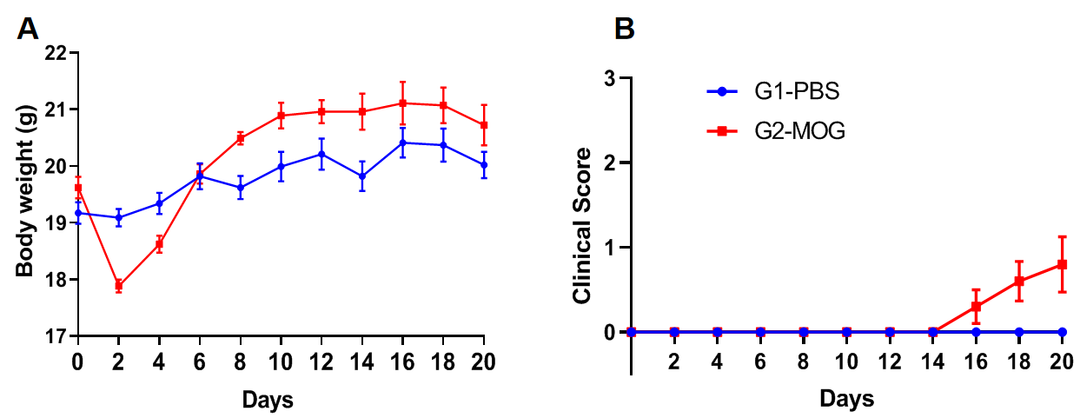
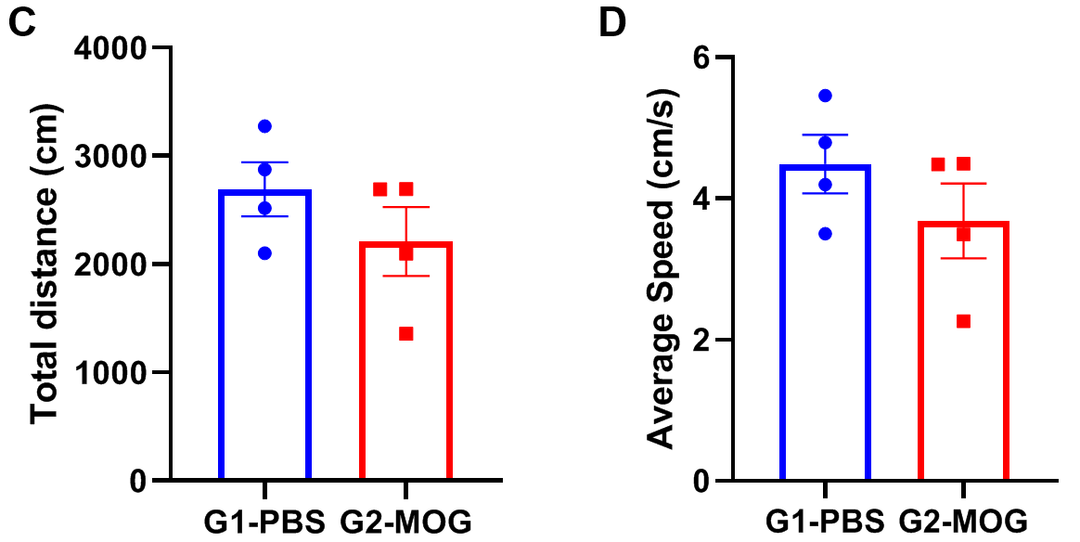
(A)体重;(B)临床评分;(C)总距离;(D)平均速度。
02.乳鼠和成年小鼠的脑室给药
由于CNS受到血脑屏障(BBB)的高度保护, 98%以上的小分子药物和几乎所有的大分子药物向脑实质中疾病部位的渗透都受到限制。在临床前的动物实验,脑室给药有时是必要的递送方法。目前,我们可以在成年鼠和乳鼠中完成脑室内的直接药物递送。
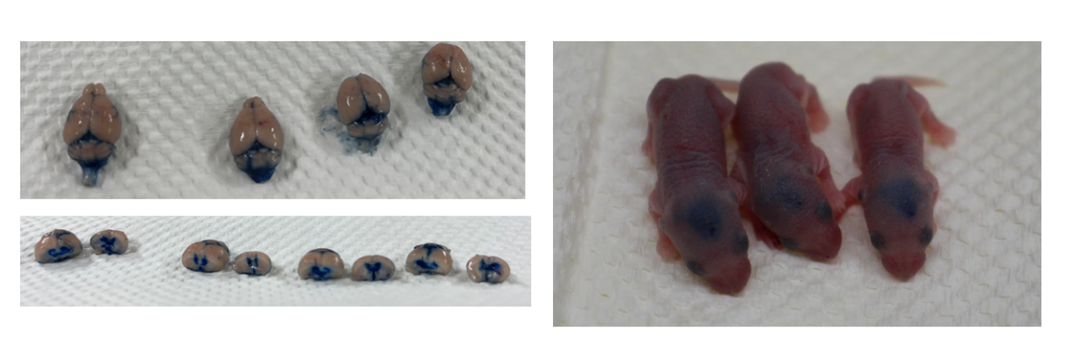
图4. 在成年小鼠(左)和P1乳鼠脑室注射埃文斯蓝
参考文献:
[1] Kuo S H., Ataxia. Continuum (Minneap Minn). 2019 August ; 25(4): 1036–1054.
[2] Keita M, Mclntyre K, Rodden L N, et al. Friedreich ataxia: clinical features and new developments. Neurodegener. Dis. Manag. 2022, 12(5), 267–283
[3] Perdomoni M, Hick A, Puccio H, et al. Animal and cellular models of Friedreich ataxia. Journal of Neurochemistry 2013 126: 65-79
[4] Haugen A , Prospero N, Parker J, et al. Altered Gene Expression and DNA Damage in Peripheral Blood Cells from Friedreich’s Ataxia Patients: Cellular Model of Pathology. PLoS Genetics 6(1): e1000812
[5] Chutake YK, Lam CC, Costello WN, Anderson MP, Bidichandani SI. Reversal of epigenetic promoter silencing in Friedreich ataxia by a class I histone deacetylase inhibitor. Nucleic Acids Res. 44(11), 5095–5104 (2016)
[6] Soragni E, Miao W, Iudicello M et al. Epigenetic therapy for Friedreich ataxia. Ann. Neurol. 76(4), 489–508 (2014).
[7] Taymans JM, Vandenberghe LH, Haute CV et al. Comparative analysis of adeno-associated viral vector serotypes 1, 2, 5, 7, and 8 in mouse brain. Hum. Gene Ther. 2007. 18(3), 195–206
[8] Belbellaa B, Reutenauer L, Messaddeq N, Monassier L, Puccio H. High levels of Frataxin overexpression lead to mitochondrial and cardiac toxicity in mouse models. Mol. Ther. Methods Clin. Dev. 2020. 19, 120–138
[9] Abeti R, Baccaro A, Esteras N, et al. Novel Nrf2-Inducer Prevents Mitochondrial Defects and Oxidative Stress in Friedreich’s Ataxia Models. Frontiers in Cellular Neuroscience. 2018. 12:188






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号