由于小鼠和人类在遗传和病理生理方面的相似性,基因工程小鼠模型通常是研究人类疾病的首选模型。特别是Cre-loxP系统已广泛用于产生条件性基因敲除/敲进小鼠。该系统可以使研究人员实现在特定组织/细胞(空间控制)和/或特定时间(时间控制)研究所感兴趣的基因。
Cre-loxP系统简介
Cre重组酶是由1981年Sternberg和Hamilton首次从P1噬菌体中分离出的可以重组DNA片段并被命名,是一种酪氨酸位点特异性重组酶(T-SSRs);Cre可识别特定的DNA片段序列loxP位点,并介导两个loxP位点之间DNA序列的位点特异性缺失。虽然Cre-loxP系统主要用于基因切除,但它也会根据loxP位点的位置和方向诱导DNA序列在两个loxP位点之间倒位和易位。
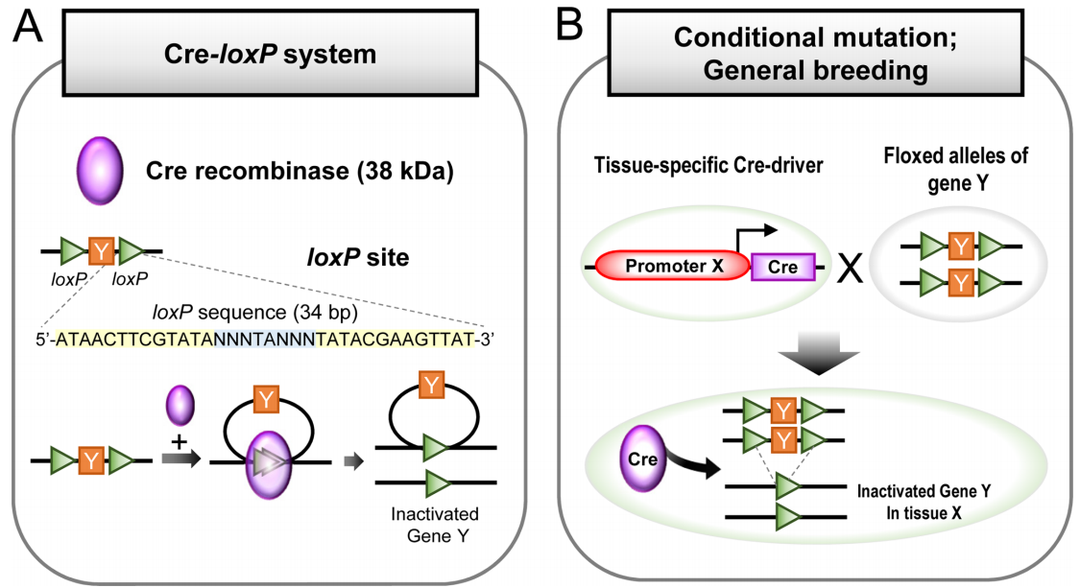
图1. Cre-loxP系统的作用机制
(A) Cre-loxP系统。38 kDa的Cre重组酶能识别34 bp DNA序列的特异性loxP位点。(B)借助loxP和Cre进行条件突变的育种策略。原则上,一只小鼠有组织特异性启动子的Cre基因,另一只小鼠有所关注的基因Y的loxP侧翼(floxed)等位基因。Cre重组酶的表达可切除floxed位点,使基因Y失活。[1]
Cre-loxP系统在mRNA药物递送载体验证中的妙用
研究报道mRNA疗法在治疗需要细胞内蛋白表达的疾病和用于基因组编辑系统方面有希望,但mRNA必须转染到所需的组织和细胞类型才能有效。然而,对于某些组织类型,将mRNA安全递送到靶组织和靶细胞类型的细胞质仍然具有挑战性。因为,mRNA固有的不稳定性需要包装/递送系统来保护其不被核酸酶降解,并允许有效的细胞摄取、细胞内释放和翻译为蛋白质。当前,各种载体如脂质和聚合物纳米颗粒等,已被用于在细胞内封装和递送mRNA载荷。
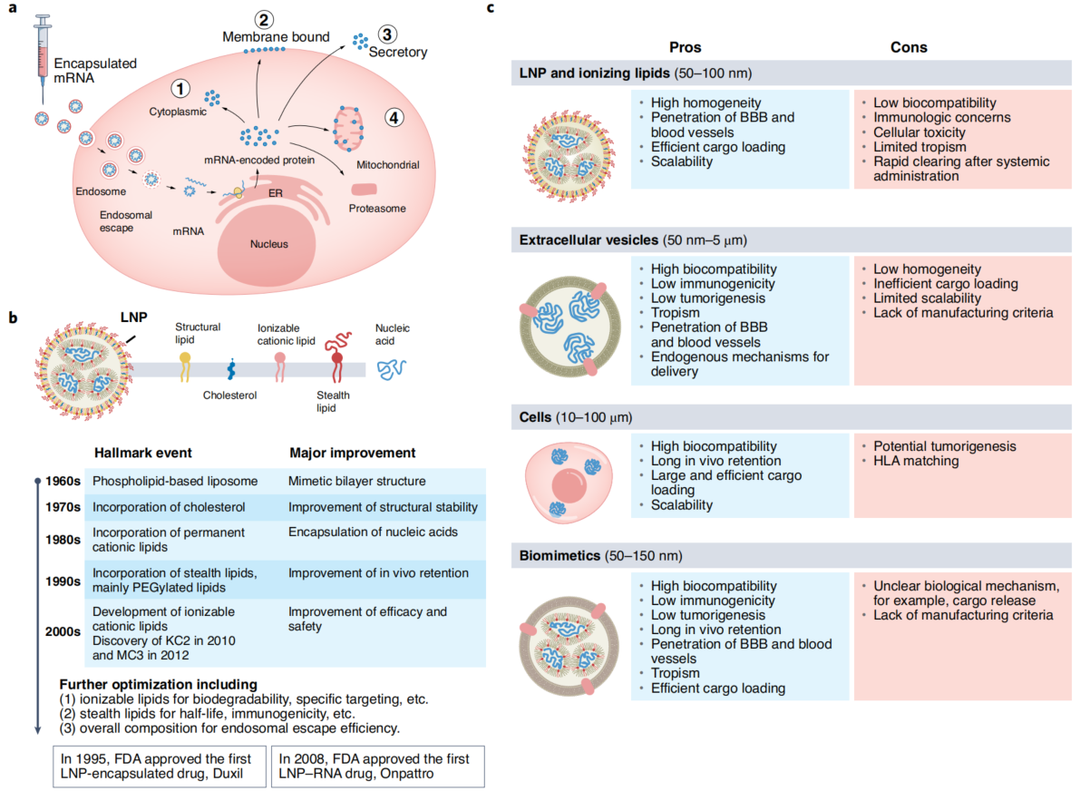
图2. mRNA的模块化递送系统
a, mRNA在细胞内递送和翻译成蛋白质。b, LNPs发展的时间线和里程碑。c、各种载体的利弊。ER, 内质网;HLA, 人类白细胞抗原。[2]
为了评估这些递送载体在体内的转染能力、生物分布和药代动力学,编码报告基因的mRNA(如生物发光荧光素酶、荧光蛋白、β-半乳糖苷酶等)通常在尝试治疗性mRNA递送之前被用于优化/验证递送系统。
递送mRNA的纳米粒子载体通常使用编码报告基因(例如萤火虫荧光素酶(FLuc))的mRNA来评估;然而,使用FLuc通常无法实现对mRNA表达的单细胞分辨,因此,在没有其他步骤或实验的情况下,无法确定转染的细胞群。为了更快速地确定mRNA制剂在体内转染的细胞类型,借助Cre-loxP系统可在转基因小鼠的转染细胞中永久表达荧光tdTomato蛋白。在体内应用载体Cre mRNA后,通过Cre介导的tdTomato在大量组织中的表达和单细胞分辨率,使成功地可视化转染细胞是可能的。利用该系统可以在体内鉴定/验证现有mRNA载体的未知转染细胞类型。
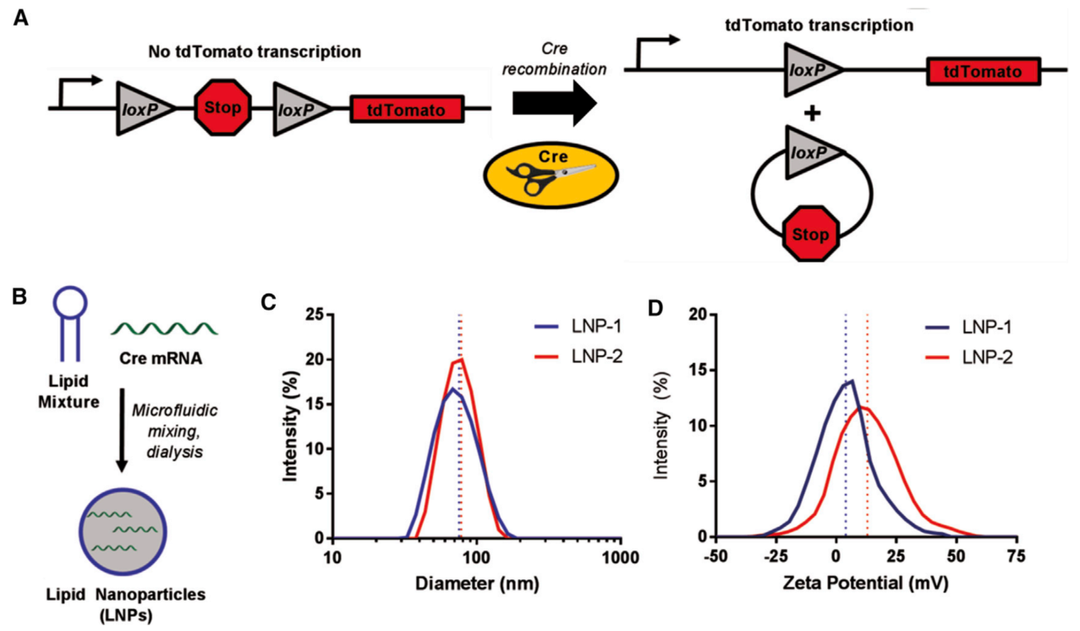
图3. Ai14/Cre mRNA小鼠模型和脂质纳米颗粒
(A)具有和不具有Cre重组的tdTomato上游loxp侧边STOP盒示意图。(B) LNP包装过程示意图。(C) LNP-1和LNP-2的直径分布。(D) LNP-1和LNP-2的Zeta电位分布。[3]
百奥动物自主开发的B-CAG tdtomato cKI mice可以应用到该项研究中,助力mRNA药物递送载体的验证。
打靶策略
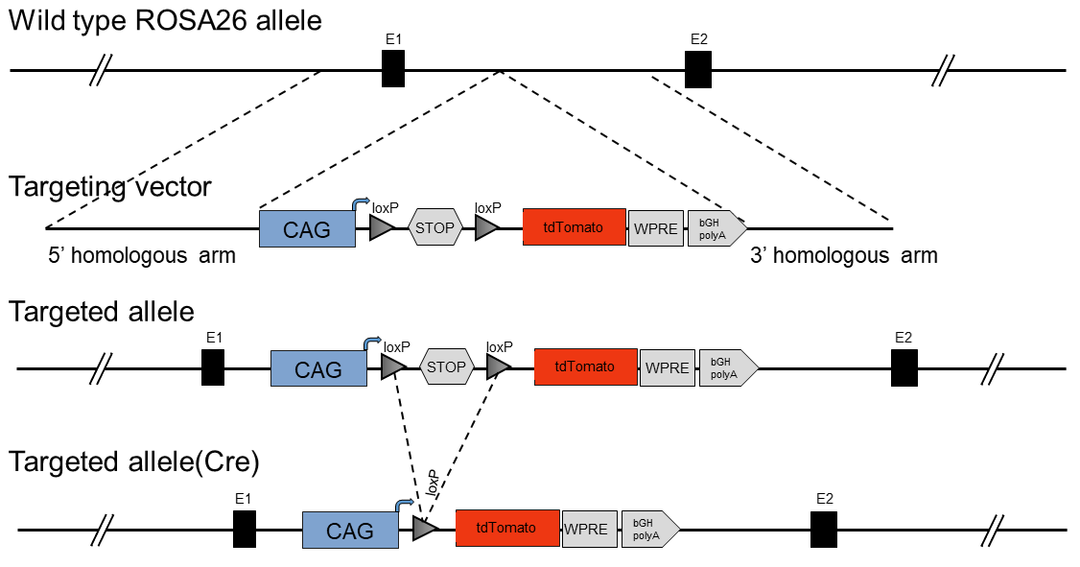
该模式小鼠是将3×STOP-CAG-tdTomato 的DNA序列以同源重组的方式嵌入到Rosa26基因下游,在有Cre表达的细胞中可以观察到红色荧光蛋白(tdTomato)的表达。
表型分析
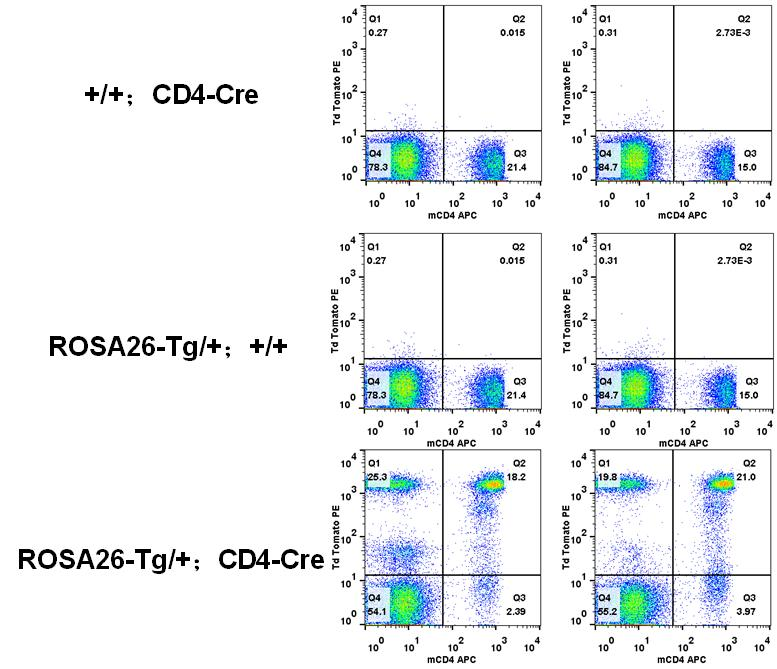
从单阳性小鼠和双阳性小鼠脾脏中分离T细胞。采用流式细胞术分析淋巴细胞亚群比例;结果:在双阳性小鼠中检测到tdTomato+细胞。
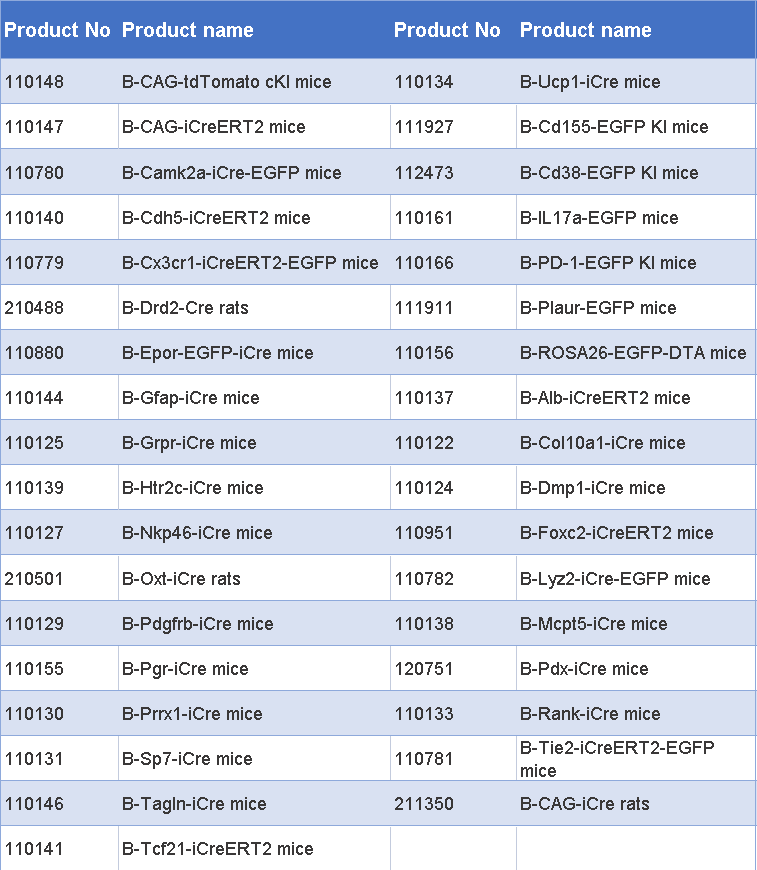
百奥动物开发的工具鼠列表
参考资料
[1]. https://doi.org/10.5625/lar.2018.34.4.147
[2]. https://doi.org/10.1038/s41587-022-01491-z
[3]. https://doi.org/10.1016/j.omtn.2017.11.005
[4]. doi: 10.1002/cpmo.22
[5]. doi: 10.1002/advs.202301929






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号