生物标志物广泛包括可以用来指征正常生理学过程、病理学过程或进行某种处理或干预(如治疗)后生物体的的某种特征。生物标志物是分子、蛋白、细胞、组织、放射成像或生理等层面的特征,可以通过各种检测方法进行定量或定性的测量对其进行深入研究。正确鉴定生物标志物,探寻其生物学合理性(即与疾病或病症的相关性)以及测量方法是药物研发中十分重要的环节[1]。随着药物研发、生物医学研究以及临床诊断市场的迅猛发展,为满足不同的检测需求,具有各自独特之处的生物标志物单因子或多因子检测技术应运而生。本文将重点介绍被称作“高通量、多重检测技术平台”的Luminex技术和被称为“第三代免疫分析技术-电化学发光免疫分析技术”的MSD-ECL。
Luminex及其在生物标志物研究中的应用
早在1997年,首篇关于Luminex技术原理介绍的文章在《Clinical Chemistry》上被刊载。2001年INOVA公司的ENA系列产品率先通过美国FDA的认证,使得Luminex xMAP®技术成为首个得到美国FDA许可,可用于临床诊断的多因子检测技术[2]。迄今为止的二十多年里Luminex正逐渐在生命科学研究领域受到越来越多的关注。
Luminex 具有两大核心技术—— xMAP®技术和 xTAG®技术。xMAP®技术又名“多功能流式点阵技术”、“液相悬浮芯片技术”、“液相芯片分析技术”等。它通过使用不同配比的红色和近红外荧光染料,将5.6 μM直径的磁性微球染成不同强度的荧光色并进行编码,检测时通过红激光激发后,读取磁珠荧光强度来识别磁珠对应编号从而判断相应的待测物种类。每一种编码的磁珠上包被有识别某一种待测物的抗体或基因探针以捕获待测物,检测时依次加入待测样品、以及荧光标记的识别待测物的检测抗体或基因探针进行孵育,此时便可形成双抗/探针夹心的结构,仪器通过测定绿色荧光通道的信号强度来实现待测物定量(Figure 1)。xMAP®技术当下更多被用于定量检测蛋白类生物标志物。
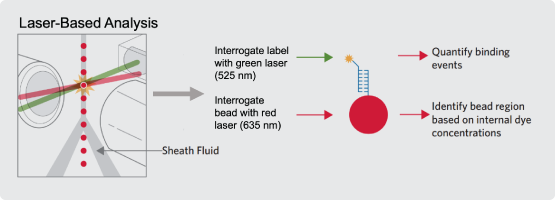
Figure 1. Principle of xMAP and xTAG.[3]
从原理上进行比较,Biomarker“金标准”方法ELISA是基于双抗夹心、采用HRP催化底物产生颜色反应的以微孔板孔底平面为固相载体的实验体系。Luminex则是基于液相反应动力学的手段,大量的微珠作为固相载体提供了更大的反应总表面积,为单样本的多因子检测提供了基础,检测时仪器仅读取微珠上的荧光信号利于增加信噪比。另外,Luminex的定量信号为荧光信号,相比于HRP酶催发底物显色反应的吸光度信号具有更高的灵敏度和信号范围。因此,与ELISA、HTRF等方法相比,Luminex xMAP的最大优势在于其可以实现同份一样品一次实验中检测数十种甚至上百种biomarker,另外也具有特异性好、实验耗时短、指标组合灵活、重复性好等特点,且其检测范围为 3~4 个数量级、检测灵敏度也优于一般的ELISA方法。基于xMAP®技术开发的生物标志物的检测种类有超过450种,消耗样本体积仅为25微升,尤其适用于在临床前小鼠动物模型上进行生物标志物的筛选和评价。
xTAG® 技术针对的则是PCR扩增后的核酸样品,其与Luminex 专有的通用标签TAG混合后,可以特异性地延伸引物并掺入标记物,再与反TAG标记的微球反应,后通过Luminex仪器检测目标引物标记的荧光信号即可获得结果[4]。该技术目前更多用于人类冠状病毒、流感病毒等、支原体等多重病原体的检测[5]。近期,也有将两种技术联用的方法被开发出来,如Luminex xTAG® 多重呼吸道病毒检测试剂盒,能快速准确地在样本中同时检测多达 20 种呼吸道病毒及亚型[6]。
Luminex的其他应用
除了可用于检测生物标志物的蛋白与核酸表达,Luminex技术也被应用于细胞治疗CRS监控、疫苗的功能性研究和药物安全性评价等方面。
抗CD19 CAR-T细胞治疗复发难治性B细胞急性淋巴细胞白血病和非霍奇金淋巴瘤的临床试验已经证明其有效性,但越来越多的研究报道了细胞因子释放综合征(CRS)的出现[7],因此在CD19 CAR-T细胞疗法的安全性评价中,CRS的发生风险已经成为一项重要的指标。一种报道的新的抗CD19、包含共刺激4-1BB和CD3ζ结构域的CAR分子,在对B细胞淋巴瘤患者展开一期临床实验时,通过Luminex技术检测了CAR T 细胞输注后多个时间点患者血浆中27种细胞因子(TNFα, IL-6, CXCL8 (IL-8), IL-7, CXCL10 (IP-10), IL-10, CCL2 (MCP-1), IL-1β, IFN-γ, CCL3 (MIP-1α), CCL22 (MDC), CCL4 (MIP-1β), CCL13 (MCP-4), IL-4, IL-17A, IL-2, CCL26 (Eotaxin-3), GM-CSF, Granzyme A, IL-15, IL-5, IL-12 p70, Granzyme B, CCL17 (TARC), IL-13, VEGF-D, CCL11 (Eotaxin))的水平,结果证明该CAR-T细胞疗法可以产生有效和持久的抗淋巴瘤效应,且不会引起神经毒性或严重的CRS[8]。抗体分子引起CRS的可能性可通过使用新鲜外周血单个核细胞(PBMCs)在体外刺激后检测培养上清中细胞因子的释放情况来评估。
CD28单克隆抗体TG1412在临床实验中出现严重的细胞因子释放综合征是免疫激动剂药物开发的重要安全性事件,后续的研究中发现,在体外研究细胞因子释放时,刺激抗体的加入形式对实验结果的影响直观重要。当以液相(Aqueous)方式加入TGN1412刺激人PBMC时,不能刺激PBMC中T细胞大量的分泌炎性细胞因子,而将TGN1412包被到细胞培养板上-干法(Air-dried)刺激人PBMC时,可以诱导大量细胞因子分泌[9]。
百奥赛图利用Luminex检测技术平台,检测了CD28激动型抗体TGN1412以不同方式处理的PBMC后上清中细胞因子的分泌情况。与文献报道相似,结果表明液相加入TGN1412处理时并未检测到IL-1β, IL-2, IL-4, IL-8,IL-10,TNF-α, CCL3, CCL4和GM-CSF等细胞因子相对对照组的浓度增加;但将TGN1412包被在微孔板底部进行刺激时,可以检测到上述9种细胞因子浓度的升高。

Figure 2. Air-dried, rather than aqueous TGN1412 could dose-dependent stimulate PBMC releasing cytokines and chemokines, while CD3ε agonist and LPS were used as positive controls.
MSD及其在生物标志物研究中的应用
MSD是基于电化学发光(Electrochemiluminescence, ECL)的免疫分析技术,又被称作“第三代免疫分析技术”。电化学发光是指通过电化学反应生成的产物之间或产物与其他物质之间发生发光反应的技术方法。与一般化学发光相比,该法具有更好的灵敏度、线性范围和重现性[10]。美国Meso Scale Discovery (MSD)公司利用该技术,在ELISA法的基础上进行了技术优化,形成了高灵敏度、低背景值、广定量范围、多靶标和低样本量检测的新一代定量免疫分析技术。在MSD-ECL的反应体系中,固相载体为镶有电极的石墨烯板,当形成双抗夹心或其他反应结合体系后,仪器内检测通电会在电极表面引起化学反应的发生,从而激发标记物SULFO-TAG产生特异性化学发光,并由CCD Camera进行信号采集。在此基础上,MSD又开发了MULTI-ARRAY多阵列技术,通过将微孔板板底的面积划分为更小面积的孔点,再加上其独特的配对Linker技术,使得在96孔板的每个孔里同时对10个指标进行定量检测成为可能。
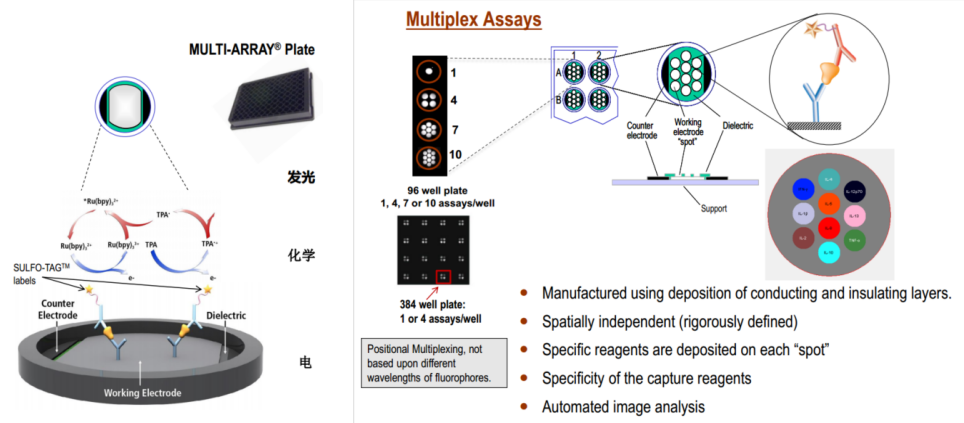
Figure 3. MSD electrochemiluminescence and its Multiplex Assays.
在Biomarker的检测应用方面,MSD的反应体系与ELISA相同,都是基于双抗夹心的结构,但MSD显示出比ELISA更优越的性能,包括①MSD使用石墨材质96孔板,捕获抗体的包被载量可增加10-50倍;②以SULFO-TAG(三联嘧啶钌) 作为发光基质,其分子量约为1000Da(约为HRP的1/40),因此空间位阻小,易于标记抗体,且不易阻碍其与待测物质或其他抗体的结合;③的激发机制(电)与响应(光信号)解耦,将基质干扰最小化;④仅激发结合在电极表面附近的SULFO-TAG,为不洗涤分析创造条件;⑤光信号在620nm处发射,消除了颜色淬灭问题;⑥循环激发和发射过程增强了光信号并提高了灵敏度;⑦SmallPot的模式支持多因子检测。
针对不同特点的Biomarker检测需求,MSD也提出了更多元化的解决方案,如针对已经在一个panel中组合成功的多个检测指标在经过充分验证后的试剂盒,MSD提供了V-plex高性能试剂盒;对于表达水平非常低的指标,MSD提供的S-plex将检测下限(LLOD)降低10到1000倍,支持fg/ml水平的检测限等。一方面,MSD提供的成品多因子检测试剂盒为biomarker的检测提供了很好的选择,如针对神经推行性疾病、肿瘤/癌症、代谢性疾病等,这些种类丰富的试剂盒保证了MSD具有较广泛的应用范围。另一方面,研究者也可以基于MSD体系,有针对性地设计和开发符合自己独特需求的biomarker检测方法。
MSD在药物研发领域的其他应用
MSD广泛应用于高灵敏度单因子或多因子的生物样品biomarker分析,以帮助评价药物作用机制和毒性相关反应等,此外由于其特殊的板材质和检测信号,使得MSD-ECL在药物分子筛选和理化性质鉴定等其他药物研发环节中也有一定的应用价值。
例如有研究团队基于MSD-ECL平台开发了相应检测方法,用于研究小分子靶向抗肿瘤药物活性。他们在MSD石墨烯板上包被抗MCL-1抗体,然后加入小分子MCL-1抑制剂处理细胞后的细胞裂解液,并加入BIM抗体和SULFO-TAG,以此来对MCL1-BIM复合物进行检测以评价两种蛋白的相互作用[11];一项以CD3ζ/CD28 为靶点的CAR-T一期临床研究就应用了5种MSD V-plex试剂盒对临床受试者的血清样本开展细胞因子检测,对该CAR-T治疗可能引起的潜在细胞因子释放综合症(CRS)风险进行评价[12]。
在大分子药物和核酸类药物的药代动力学研究和免疫原性分析中,基于MSD-ECL体系建立的生物分析方法也发挥了重要作用。在大分子药物代谢研究中,ELISA已经成为最常用的检测技术,但在大分子药物的联合治疗中,如果用ELISA作为检测手段,就需要分两次测定药物水平,这在样本管理、数据报告和成本等许多方面都有一定的挑战,但MSD的U-PLEX平台在此时提供了一种简单而灵活的解决思路。越来越多的临床前和临床研究以这种模式进行方法的开发,且不断证明了该法在准确性、精密度和交叉反应性均具有符合监管指南要求的性能,尤其适用于联合治疗样本的检测[13]。
随着基因治疗的迅速发展,从生物样品中检测和定量核酸药物也是药物研发中重要的课题。除了腺相关病毒(Adeno associated virus,AAV)载体的衣壳蛋白类成分可以通过LBA法的MSD-ECL技术进行检测外[14],在siRNA/ASO的药代动力学研究中,尽管已经有基于液相色谱-质谱法(LC-MS)和大小排阻色谱法(SEC),以及在PCR法的基础上开发的,如引物延伸RT-PCR、干环RT-PCR和竞争定量PCR等方法,但这些方法可能存在成本高昂、灵敏度不佳等弊端,因此基于ELISA的杂交技术也开始被应用于核酸药物的检测。该方法使用两种寡核苷酸探针替代了LBA双抗夹心法中的捕获和检测抗体,一种寡核苷酸探针通过3′端的生物素的被捕获在板底,而其5′端的9-mer 外伸则可以结合目标核酸片段,另一种探针则与捕获外伸互补的碱基结合形成杂交复合物,同时该探针3′端的地高辛结构可以与抗体结合偶联检测信号。Amgen公司在ELISA平台开发了锁核酸(LNA)的杂交连接法来定量血清和组织样本中的双链完整siRNA,并通过进一步优化,成功将其转移到MSD-ECL上来获取更高的灵敏度,优化后方法的定量下限达到了1.0 pM[15]。
免疫原性是影响抗体类药物的临床应用有效性和安全性的重要因素,当前抗体药物研发已经尽可能使用高度人源化改造抗体甚至是全人源抗体来最大程度减少其免疫原性,但由于免疫原性发生机制尚不明确、影响因素复杂,所以仍然无法完全避免。因此ADA(Anti-Drug-Antibody)检测成为监测药物免疫原性,避免对患者产生进一步损害的重要问题。关于ADA检测,美国FDA在2016年更新了《免疫原性指导原则》,对免疫原性的评估指导给出了规范性指导的具体要求。常规分析技术包括直接/桥连法ELISA、电化学发光法(MSD-ECL)、放射免疫沉淀分析(RIPA)、表面等离子体共振(SPR)等,可采取一种或几种组合。与ELISA法相同,MSD-ECL也有直接法、间接法和桥连法三种模式,目前应用MSD-ECL已被报道应用于单克隆抗体药物[16]、ADC药物[17]、疫苗[18]、核酸药物[19],以及联合给药情况下[20]。
MSD-ECL在抗体分子开发的环节,如抗体亲和力分析[21]、抗体药物[22]和ADC抗体药物[23]的药物活性分析等许多研究中均有越来越多的应用。
在过去的20年里,新治疗模式,如核酸治疗、细胞治疗等的出现和发展改变了生物分析领域的现状,并伴随着各种技术的发展和成熟。根据分子结构、内源性对应物干扰和基质蛋白-蛋白相互作用要求,LC/MS、LBA和流式细胞术仍然是广泛使用的生物分析工具。对于寡核苷酸和基因治疗,qPCR、支链DNA、杂交免疫测定和ELISPOT等新方法及其衍生技术也已被成为重要的工具方法。新药物模式的复杂结构和多种作用机制给PK、PD和免疫原性评估带来了重大挑战[24]——更高的灵敏度、更多的分析指标、更微量的样本消耗、更广的检测和定量范围,甚至是更加开放的技术平台和更简单的设备操作等,各项需求正在推动超灵敏和multiplex等新方法的发展,但在缺乏对新方法和现有方法的监管指导的情况下,根据研究需求选择、优化或开发更适合的方法,尽可能遵循可适用的法规进行充分的验证可以减轻在数据质量、数据可比性和数据完整性等关键方面带来的风险,为药物研发提供更加强有力的保证。
百奥赛图药理药效部建立了基于ELSIA、Luminex、MSD、q-PCR、WB、流式细胞术等一系列完整成熟的biomarker和PK生物分析的技术平台,针对临床前药理药效研究提供从整体实验设计、方法开发验证、样品检测到结果分析的一站式定制化服务,满足从早期分子筛选到IND申报的各阶段研究需求。

参考文献
[1] FDA-NIH Biomarker Working Group, BEST (Biomarkers, EndpointS, and other Tools) Resource. Food and Drug Administration (US); 2016.
[2] 周晓芳,盛海刚.Luminex系统的技术原理与应用[J].临床检验杂志,2010,28(04):247-249.
[3] https://www.luminexcorp.com/zh/xmap-technology/#instruments.
[4] https://www.luminexcorp.com/zh/xtag-technology/.
[5] Chen JHK, et al. Clinical Evaluation of the New High-Throughput Luminex NxTAG Respiratory Pathogen Panel Assay for Multiplex Respiratory Pathogen Detection. J Clin Microbiol. 2016 Jul;54(7):1820-1825.
[6] Krunic N, et al. xTAG RVP assay: analytical and clinical performance. J Clin Virol. 2007 Nov;40 Suppl 1:S39-46.
[7] Maude SL, et al. CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia. Blood. 2015 Jun 25;125(26):4017-23.
[8] Ying Z, et al. A safe and potent anti-CD19 CAR T cell therapy. Nat Med. 2019 Jun;25(6):947-953.
[9] Suntharalingam G, et al. Cytokine Storm in a Phase 1 Trial of the Anti-CD28 Monoclonal Antibody TGN1412[J]. N Engl J Med, 2006, 355(10):1018-1028.
[10] 分析化学 第29 卷 第1期 徐国宝等 : 电化学发光及其应用 105 106 分析化学 第29 卷 (6) 电化学发光机理的研究。
[11] Leverson JD, et al. Potent and selective small-molecule MCL-1 inhibitors demonstrate on-target cancer cell killing activity as single agents and in combination with ABT-263 (navitoclax). Cell Death Dis. 2015 Jan 15;6(1):e1590.
[12] Locke FL, et al. Phase 1 Results of ZUMA-1: A Multicenter Study of KTE-C19 Anti-CD19 CAR T Cell Therapy in Refractory Aggressive Lymphoma. Mol Ther. 2017 Jan 4;25(1):285-295.
[13] Tang H, et al. Development and validation of a multiplexed drug level assay in support of combination biologics therapy clinical studies. J Pharm Biomed Anal. 2019 Jul 15;171:204-211.
[14] Sandza K, et al. Ultra-sensitive AAV capsid detection by immunocapture-based qPCR following factor VIII gene transfer. Gene Ther. 2022 Feb;29(1-2):94-105.
[15] Thayer MB, et al. Application of Locked Nucleic Acid Oligonucleotides for siRNA Preclinical Bioanalytics. Sci Rep. 2019 Mar 5;9(1):3566.
[16] Cludts I, et al. Anti-therapeutic antibodies and their clinical impact in patients treated with the TNF antagonist adalimumab. Cytokine. 2017 Aug;96:16-23.
[17] Nakayama H, et al. A phase I study of inotuzumab ozogamicin as a single agent in pediatric patients in Japan with relapsed/refractory CD22-positive acute lymphoblastic leukemia (INO-Ped-ALL-1). Int J Hematol. 2022 Oct;116(4):612-621.
[18] lter G, et al. Immunogenicity of Ad26.COV2.S vaccine against SARS-CoV-2 variants in humans. Nature. 2021 Aug;596(7871):268-272.
[19] Machiels JP, et al. A phase 1 dose escalation study of the oncolytic adenovirus enadenotucirev, administered intravenously to patients with epithelial solid tumors (EVOLVE). J Immunother Cancer. 2019 Jan 28;7(1):20.
[20] https://www.mesoscale.com/~/media/files/scientific%20poster/poster-smithers-multiplexed%2 0 immunogenicity%20assay-2015.pdf
[21] Wang J, et al. Durable blockade of PD-1 signaling links preclinical efficacy of sintilimab to its clinical benefit. MAbs. 2019 Nov-Dec;11(8):1443-1451.
[22] 郭莎,等. 抗PD-L1单抗的质量控制研究[J]. 药物分析杂志,2019,39(1):13-22.
[23] https://www.eag.com/wp-content/uploads/2017/11/M-031117_A-Cell-Based-Assay-to-Assess-the-Binding-Activity-of-an-Antibody-Drug-Conjugate.pdf.
[24] Shi J, et al. Bioanalysis in the Age of New Drug Modalities. AAPS J. 2021 May 3;23(3):64.






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号