每年11月14日是联合国糖尿病日,其前身是世界糖尿病日,由世界卫生组织和国际糖尿病联盟于1991年共同发起。2006年底联合国通过决议,从2007年起,将“世界糖尿病日”正式更名为“联合国糖尿病日”。
糖尿病是全球常见的慢性病,由胰岛素分泌不足或胰岛素利用障碍引起的碳水化合物、蛋白质、脂肪代谢紊乱性疾病,是一种多因素的代谢性疾病,病因暂不明确,以高血糖为主要标志。随着疾病进展,血糖长期超过正常范围,糖尿病人周围血管和末梢神经病变,逐渐出现多系统损伤,容易引起眼睛、足部、心血管、肾脏、神经等组织器官的慢性进行性病变,甚至功能减退、衰竭,可导致心脑血管疾病、失明、肾功能衰竭、截肢等,已经成为严重危害人类健康的慢性疾病之一。
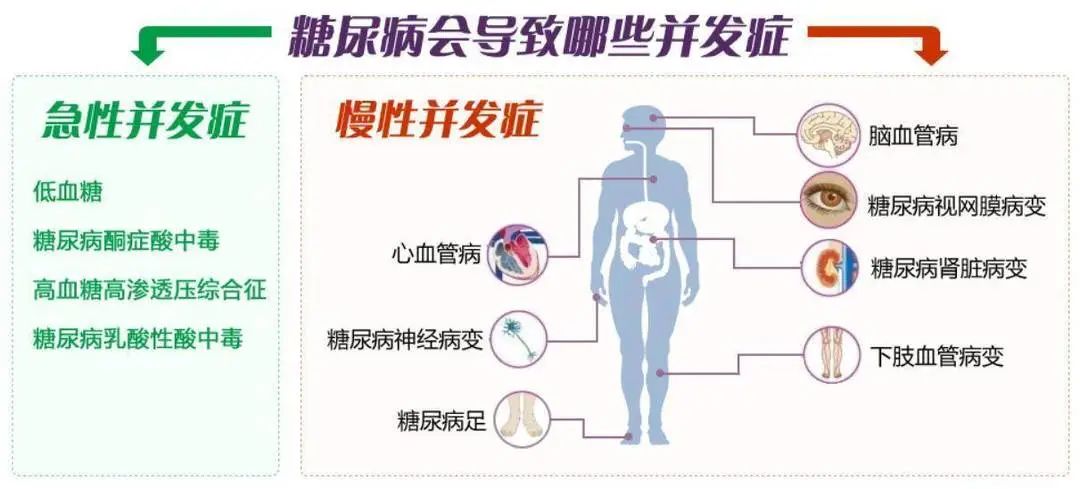
糖尿病致残致死的主要原因[1]
2021年12月,国际糖尿病联盟(International Diabetes Federation,IDF)官方网站发布了2021年全球糖尿病地图。数据显示,2021年糖尿病导致670万人死亡——每5秒死亡1人。全球有5.37亿20-79岁的成年人患有糖尿病,这占该年龄组全球人口的10.5%。预计到2030年,总人数将上升至6.43亿(11.3%),到2045年将上升至7.83亿(12.2%)。大约2.4亿人患有未确诊的糖尿病,这意味着几乎二分之一的患有糖尿病的成人不知道他们患有这种疾病,几乎90%的未确诊糖尿病患者生活在中低收入国家。[2]
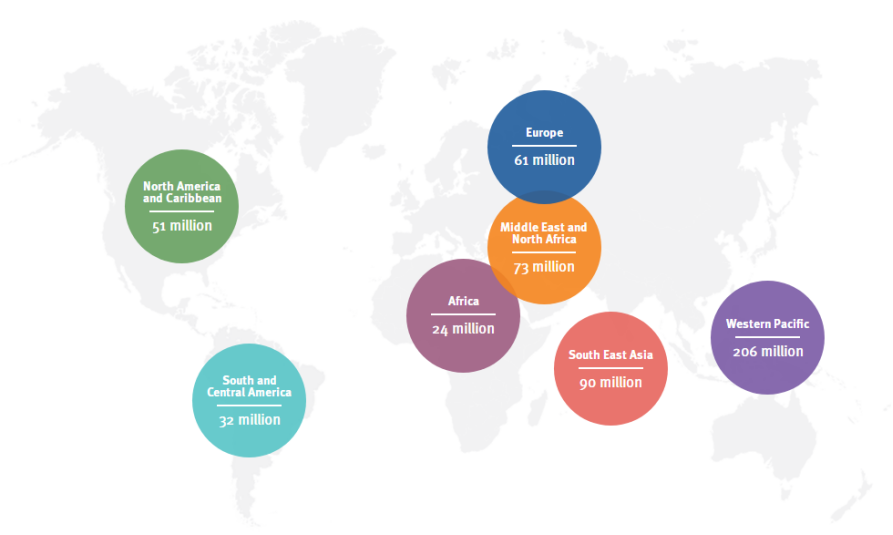
2021年全球糖尿病地图[2]
我国2021年20-79岁成年人糖尿病患者总数、未被诊断糖尿病患者数量、因糖尿病导致的死亡人数均排名全球第一。新版IDF地图数据显示,过去的10年间(2011年~2021年),我国糖尿病患者人数由9000万增加至1亿4000万,增幅达56%,其中约7283万名患者尚未被确诊,比例高达51.7%。[2]
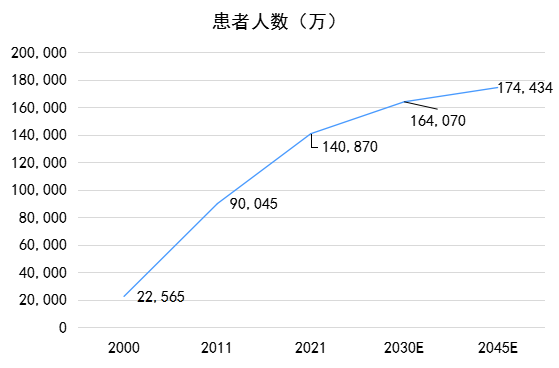
2000年-2045年中国糖尿病患者报告[3]
随着患者的逐年递增,我国糖尿病药物市场规模快速增长。2016-2022年,我国糖尿病药物市场规模从470亿元预计上升至862亿元。2021年其市场规模约为746亿元,同比增长18.04%。随着我国社会经济发展,越来越多糖尿病药物被纳入医保,药物不断创新发展,预计我国糖尿病药物市场规模将逐步扩大,市场前景广阔。
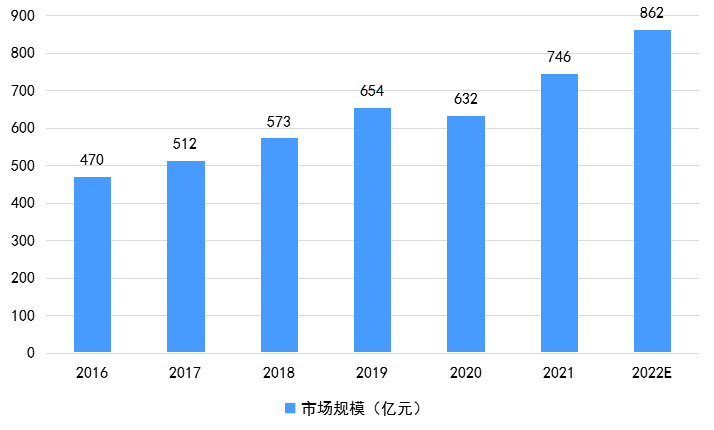
2016-2022中国糖尿病药物市场规模趋势图[4]
针对糖尿病的研究和新药开发的需求,百奥动物建立了稳定的糖尿病相关指标检测技术,并构建了自发性糖尿病模型B-ob/ob、STZ诱导糖尿病模型以及B-hGLP1R、B-hGCGR人源化小鼠,是糖尿病相关药物药效评价的优质模型,助力糖尿病药物研发。
自发性糖尿病模型B-ob/ob
瘦素(Leptin)是由一条肽链构成的肽类激素。主要由脂肪细胞分泌,其表达主要在白色脂肪组织,此外,在心肌、骨胳肌、胎盘、肺、乳腺上皮和胃黏膜等均有表达。在功能上能够抑制食欲,增加能量消耗,抑制脂肪合成促进其分解。胰岛素可促进瘦素的分泌,反过来瘦素对胰岛素的合成、分泌发挥负反馈调节作用。
百奥动物将Leptin基因2、3号外显子敲除制备的B-ob/ob小鼠:具有肥胖症和高血糖症状,是研究高血糖和肥胖症的有力模型。
基本信息

药效评价
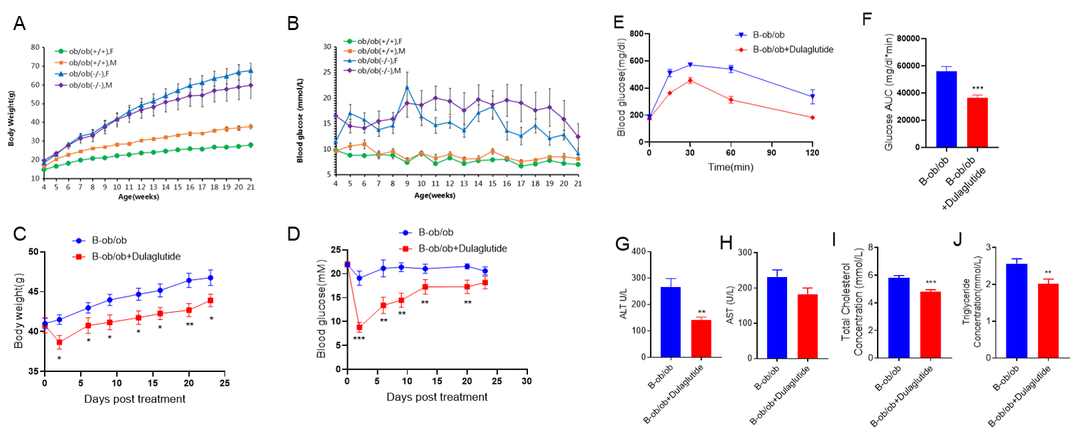
GLP1R激动剂Dulalgutide(内部合成)可降低B-ob/ob小鼠血糖
(A-B) 4-21周龄时B-ob/ob小鼠的体重和血糖变化。(C-F) 9周龄B-ob/ob小鼠分组后给药Dulalgutide(内部合成) 1mg/kg,每周2次,连续4周。在指定时间记录体重和血糖。末次给药次日进行糖耐量试验(n=8)。(G-J)Dulalgutide对B-ob/ob小鼠的血液生化试验。数值表示为平均值±SEM。**p<0.01, ***p<0.001。(每组8只)。
可提供服务内容

STZ诱导糖尿病模型
链脲佐菌素(Streptozotocin,STZ)是一种能特异性破坏胰岛B细胞的抗生素,通过诱导一氧化氮(NO)的合成,增加胰岛B细胞的氧化侵袭,被广泛用于制造1型糖尿病(T1DM)的模型。
一般认为低剂量多次注射STZ可诱发实验动物发生1型糖尿病。其机制可能是低剂量STZ注射后,少量胰岛细胞被破坏,死亡的胰岛细胞被巨噬细胞释放致敏蛋白作为抗原。吞噬作用,产生Th1刺激因子(IL-12),诱导IL-2、IFN-分泌增加,在局部胰岛形成炎性细胞浸润,释放IL-1β、TNF-α、IFN-γ、氧自由基等细胞因子杀死少量细胞,死亡细胞以自身为抗原,经APC细胞处理后释放细胞因子,放大细胞损伤效应,最终导致1型糖尿病。
STZ诱导糖尿病小鼠模型的建立
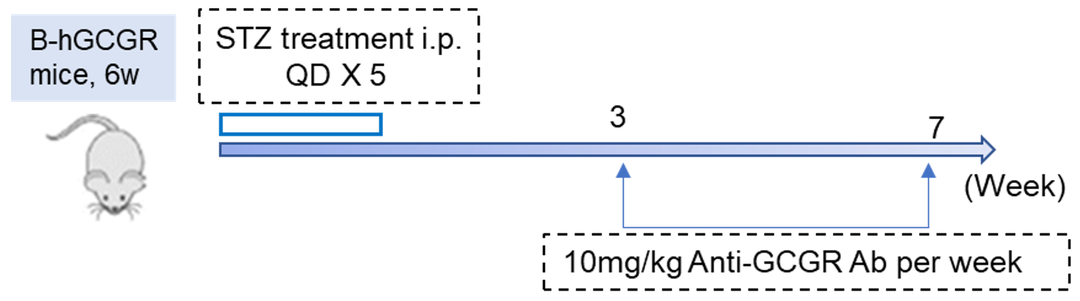
药效评价
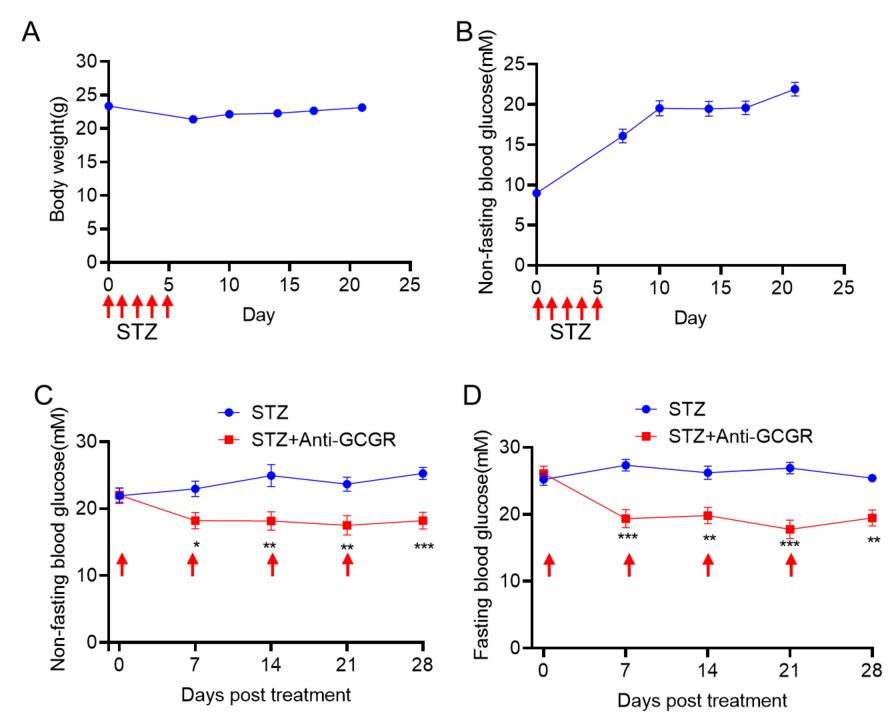
GCGR抗体对STZ诱导的B-hGCGR小鼠的降糖作用
(A-B)STZ (50mg/kg)诱导B-hGCGR小鼠(6周龄)后体重和血糖的变化。STZ诱导3周后,每周给药GCGR抗体(10mg/kg,内部合成)1次,(C-D)测定血糖,非空腹血糖(C)空腹血糖(D)。
可提供服务

高脂饮食诱导糖尿病模型
01、B-hGLP1R mice
GLP1R是G蛋白偶联受体胰高血糖素受体家族的一员,由存在于人6号染色体上的GLP1R基因合成,分布在胰腺的β细胞和大脑的神经元上,通过促进胰岛素分泌来控制血糖水平。
GLP1R由两个结构域组成,一个是与GLP-1的C端螺旋结合的胞外结构域(ECD),一个是与GLP-1的N端区域结合的跨膜结构域(TMD)。在TMD结构域有一个极性残基支点,调节受体的偏激信号,而跨膜螺旋边界和细胞外表面是偏激激动的触发器。在糖尿病中,GLP-1R信号通路通过上调cAMP,进而激活PKA和cAMP激活的交换蛋白,增强葡萄糖依赖性胰岛素的分泌。
基本信息

药效评价
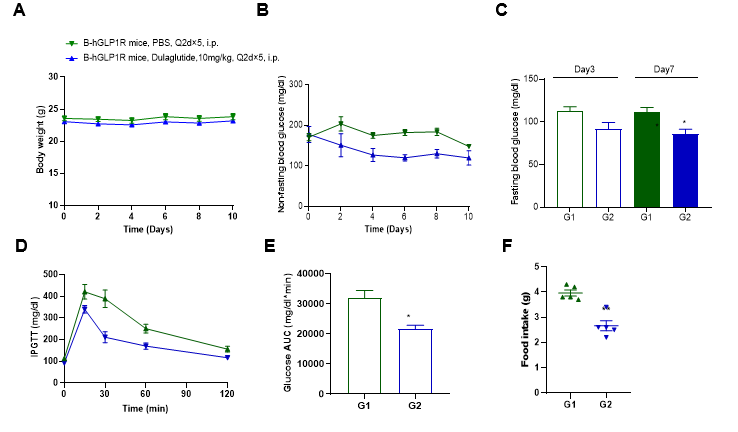
Dulaglutide降低B-hGLP1R小鼠的血糖
B-hGLP1R小鼠(雄性,7-8周龄, n=5)注射Dulaglutide(内部合成)或PBS后,采集多个时间点的血液进行分析。(A)体重。(B)非空腹血糖。(C)空腹血糖。(D)IPGTT。(E)IPGTT曲线下面积(AUC)。(F)食物摄入。结果表明:实验期间小鼠体重无明显变化,与PBS相比,Dulaglutide降低了B-hGLP1R小鼠的非空腹血糖和空腹血糖。IPGTT结果表明:与PBS相比,Dulaglutide提高了葡萄糖耐量,同时我们观察到Dulaglutide治疗24小时后摄入的食物重量明显下降。结果表明,B-hGLP1R小鼠为评价相关药物提供了有效的临床前动物模型。数值表示为平均值±SEM。IPGTT:腹腔内葡萄糖耐量试验。
Dulaglutide减少B-hGLP1R小鼠的食物摄入量
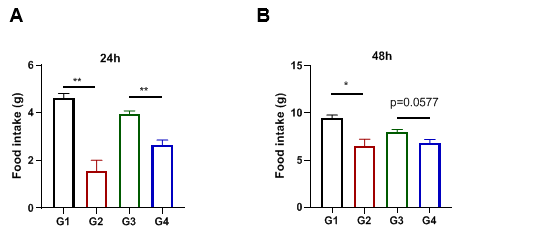
分别对C57BL/6和B-hGLP1R小鼠(雄性,15w, n=5)在Dulaglutide治疗24和48小时后的摄食量进行监测,然后计算每个笼子的摄食量并校正每只小鼠的摄食量。(A)24小时进食。(B)48小时内的食物摄入量。结果显示:Dulaglutide低了C57BL/6(G1、G2)和B-hGLP1R(G3、G4)小鼠的摄食量。数值表示为平均值±SEM。

Dulaglutide的体内药效时间表
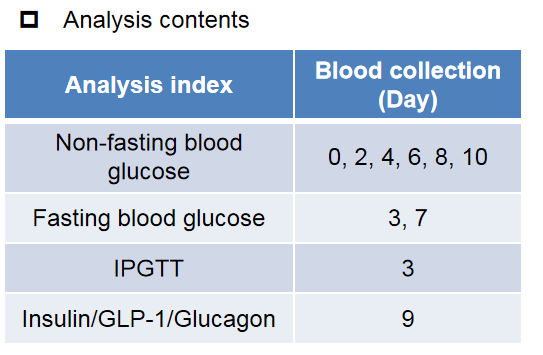
B-hGLP1R(雄性,n=10)小鼠饲喂高脂饮食12周,诱导小鼠肥胖。然后,根据体重对小鼠进行随机分组。注射药物24小时后,测量并计算食物摄入量。分组后第1 ~ 8天,每2天皮下注射Dulaglutide(内部合成)。在示意图和表中所示的日期采集血液,测量血糖和IPGTT。在IPGTT中测量血浆胰岛素。
Dulaglutide降低肥胖B-hGLP1R小鼠的血糖
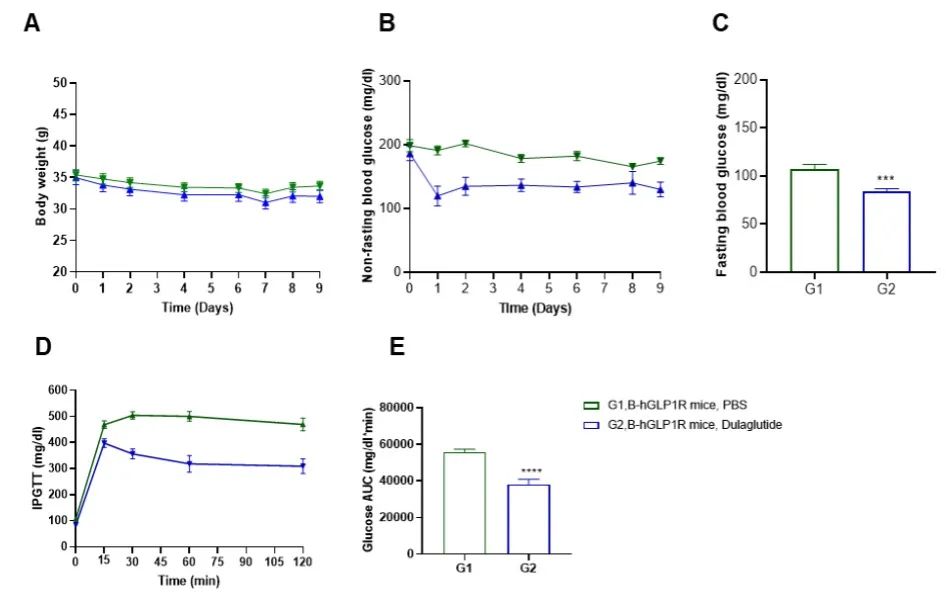
B-hGLP1R小鼠(雄性,n=10)注射Dulaglutide(内部合成)或PBS后,采集多个时间点的血液进行分析。(A)体重。(B)非空腹血糖。(C)空腹血糖。(D)腹腔内葡萄糖刺激后的血糖水平。(E) IPGTT曲线下面积(AUC)。(F)食物摄入。结果显示:实验期间小鼠体重无明显变化,与PBS相比,Dulaglutide降低了降低了非空腹血糖和空腹血糖。IPGTT结果显示:与PBS相比,Dulaglutide提高了葡萄糖耐量。结果表明,B-hGLP1R小鼠为评价糖尿病药物提供了有效的临床前动物模型。数值表示为平均值±SEM。IPGTT:腹腔内葡萄糖耐量试验。
Dulaglutide通过增加B-hGLP1R肥胖小鼠的胰岛素分泌、减少胰高血糖素分泌来调节血糖,并影响食物摄入
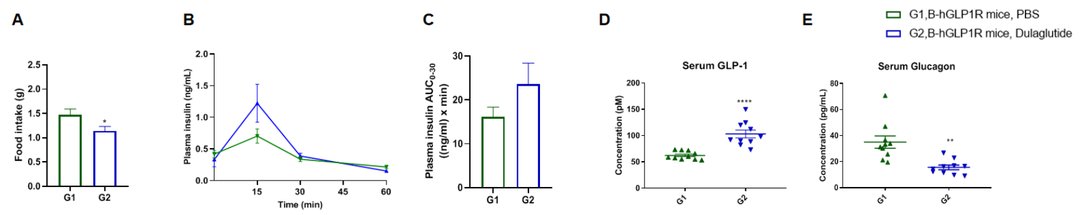
测定C57BL/6小鼠和B-hGLP1R小鼠(雄性,n=10)在Dulaglutide治疗24h后的摄食量。IPGTT测定血浆胰岛素。采集C57BL/6和B-hGLP1R小鼠血清进行GLP-1和胰高血糖素分析。(A)治疗后24h的食物摄入量。(B)血浆胰岛素分泌。(C)0-30分钟血浆胰岛素曲线下面积。(D)血清GLP-1。(E)血清胰高血糖素。结果表明:Dulaglutide降低了B-hGLP1R小鼠的食物摄入量。同时升高胰岛素和GLP-1分泌,减少胰高血糖素分泌,这与控制血糖的机制一致。数值表示为平均值±SEM。IPGTT:腹腔内葡萄糖耐量试验。
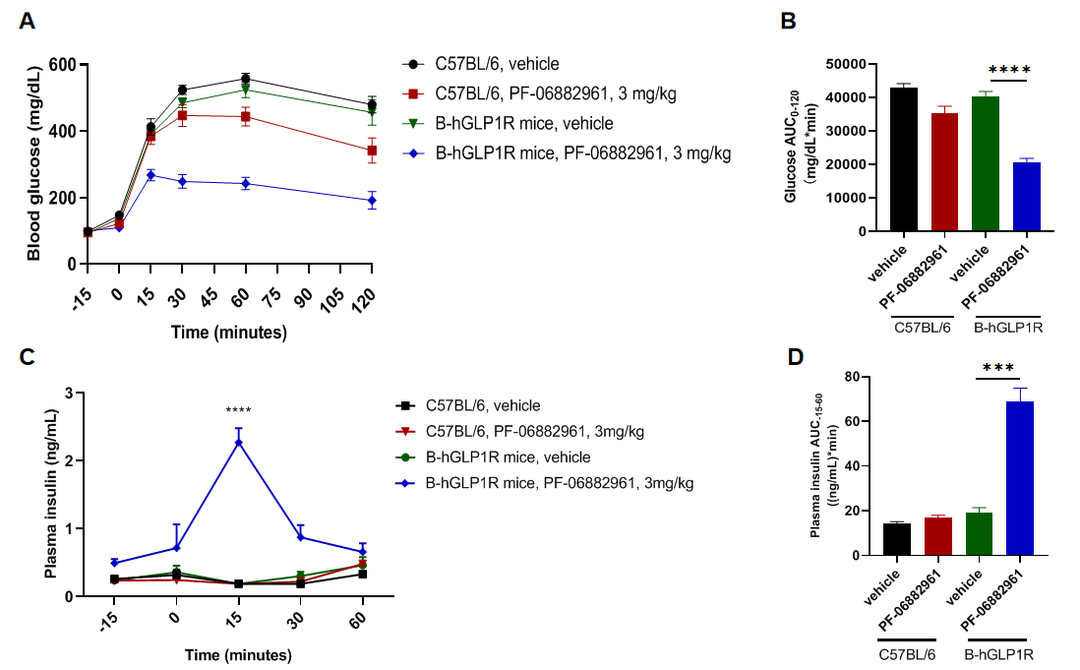
PF-06882961改善B-hGLP1R小鼠的糖耐量和胰岛素水平
C57BL/6小鼠和B-hGLP1R小鼠(n=6)皮下给药后的IPGTT研究。(A)血糖。(B)血糖AUC0-120。(C)血浆胰岛素。(D)血浆胰岛素AUC-15-60。结果表明:PF-06882961可提高B-hGLP1R小鼠的糖耐量,但对C57BL/6小鼠无明显影响,并可提高血浆中胰岛素含量。数值表示为平均值±SEM。
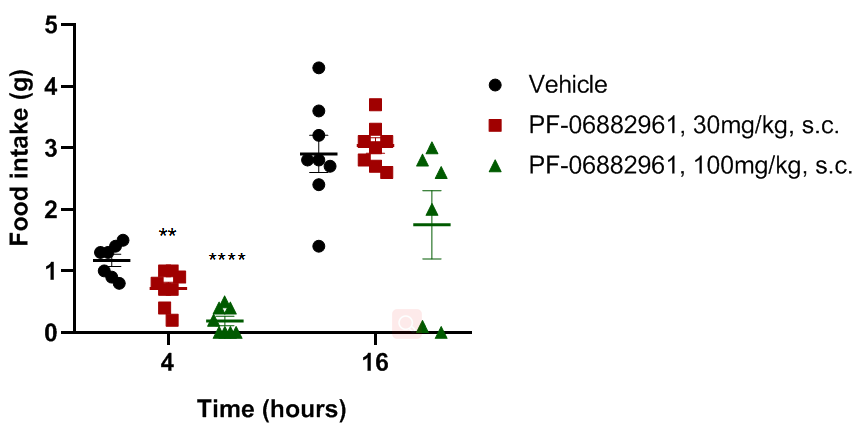
PF-06882961抑制B-hGLP1R小鼠的摄食量
B-hGLP1R小鼠(n=6)皮下注射vehicle或PF-06882961后4小时和16小时的摄食量进行监测。结果表明:食物摄入在4小时内受到显著抑制,但在16小时内没有。数值表示为平均值±SEM。
02、B-hGCGR mice
GCGR编码一种胰高血糖素受体,它对控制血糖水平很重要。该基因的缺陷是导致非胰岛素依赖型糖尿病(NIDDM)的一个原因。人胰高血糖素受体(GCGR)被其内源性配体胰高血糖素激活,在禁食期间触发肝脏释放葡萄糖,使其成为治疗2型糖尿病的潜在药物靶点。
基本信息

药效评价
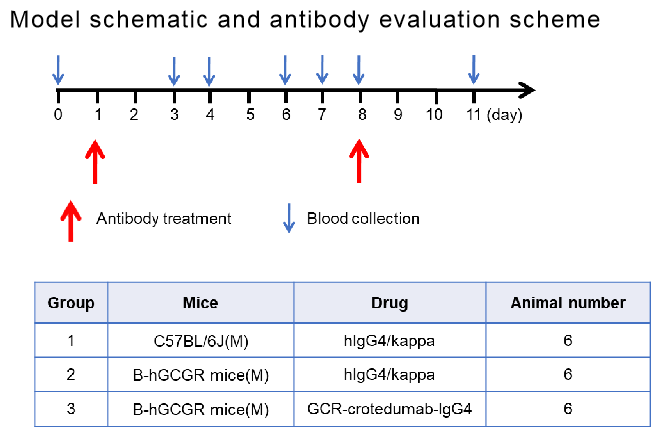

抗人GCGR抗体在体内疗效的实验计划
抗人GCGR抗体-crotedumab(内部合成)在第1 和 8天腹腔注射1次。采集血液,分析示意图和表中所示天数的血糖、胰岛素、胰高血糖素和血脂。
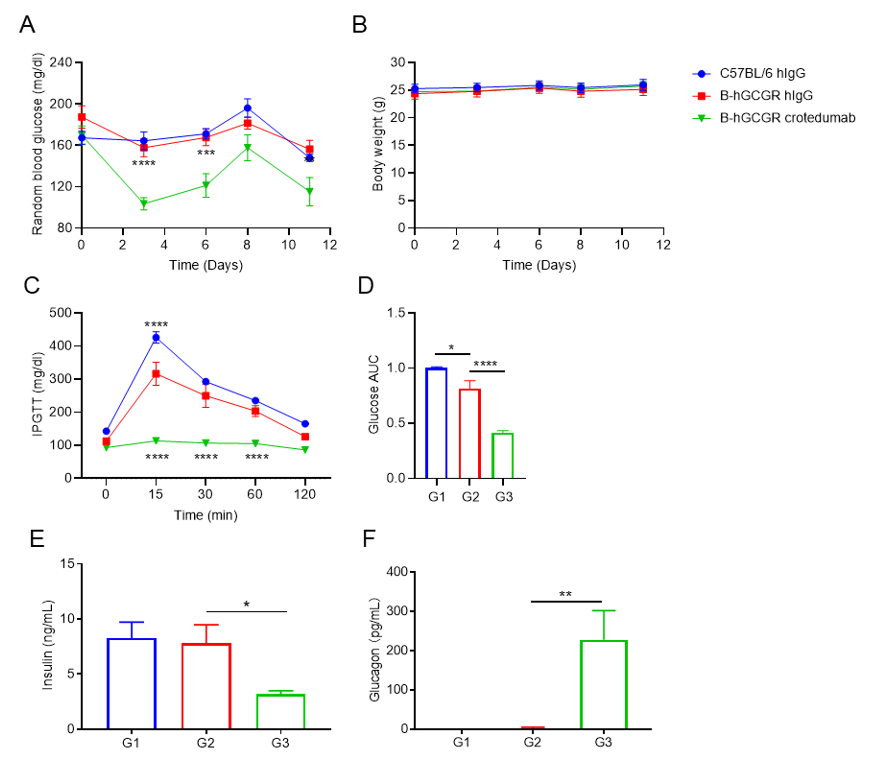
抗人GCGR抗体降低B-hGCGR小鼠血糖
按照实验计划方案,(A)注射crotedumab(内部)或同型对照抗体前和后多个时间点,检测小鼠(雄性,n=6)的随机血糖。(B)体重。(C)第4天OGTT。(D) OGTT曲线下面积。第7天的血清(E)胰岛素水平,(F)胰高血糖素水平。与B-hGCGR同型抗体相比,抗人GCGR抗体降低小鼠随机血糖、空腹血糖和OGTT。抗体治疗组血清胰岛素水平略有降低,胰高血糖素水平明显升高。B-hGCGR小鼠的所有结果与C57BL/6小鼠的结果相似。结果表明,人源化B-hGCGR小鼠的血糖调节功能与C57BL/6相似。抗人GCGR抗体能有效控制B-hGCGR小鼠的血糖。数值表示为平均值±SEM。OGTT:口服葡萄糖耐量试验。

抗人GCGR抗体降低DIO B-hGCGR小鼠血糖
B-hGCGR小鼠(雄性,n=10)在整个研究过程中均饲喂高脂饮食。在饮食诱导后第0天腹腔注射抗人GCGR抗体crotedumab(内部合成)。定期测量体重、血糖和激素水平。(A)体重。(B)B-hGCGR小鼠在注射crotedumab(内部合成)或同型抗体前和注射后多个时间点的随机血糖。(C)第5天进行IPGTT。(D)IPGTT曲线下面积。IPGTT表明:第14天和第28天的血清水平胰岛素(E),胰高血糖素(F), GLP-1(G)与对照组相比,抗GCGR抗体显著降低雄性DIO B-hGCGR小鼠的体重、随机血糖和IPGTT。血清胰岛素、胰高血糖素和GLP-1水平呈剂量依赖性变化。结果表明:抗人GCGR抗体对B-hGCGR小鼠的体重和血糖有一定的控制作用。数值表示为平均值±SEM。IPGTT:腹腔内葡萄糖耐量试验。
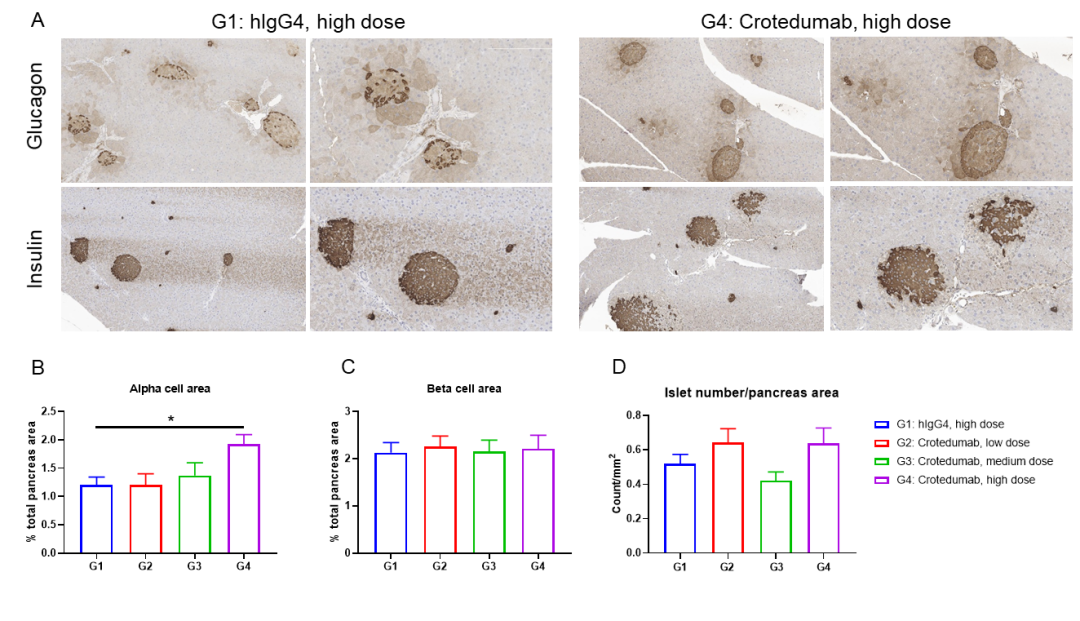
单剂量抗人GCGR抗体治疗可诱导DIO B-hGCGR小鼠α细胞增生
B-hGCGR小鼠在整个研究过程中均饲喂高脂饮食(雄性,n=10)。在第0天腹腔注射抗人GCGR抗体crotedumab(内部合成),进行95天的饮食诱导。在第28天收集胰腺进行形态计量分析。(A)代表性胰腺切片胰高血糖素和胰岛素免疫组化。α细胞面积(B)和β细胞面积(C)用(A)表示。(D)每个胰腺切片的胰岛数量。结果表明:α细胞面积呈剂量依赖性增加。抗人GCGR抗体对β细胞面积和胰岛数量无影响。数值表示为平均值±SEM。
糖尿病病因暂不明确,目前还没有特意而有效的防治及治愈方法。日常可通过控制饮食结构、保持健康体重以及适量运动等健康的生活习惯,预防疾病发生以及延缓病情加重。
参考资料:
[1]https://max.book118.com/html/2018/0808/8133051063001117.shtm
[2]https://diabetesatlas.org/
[3]https://diabetesatlas.org/data/en/country/42/cn.html
[4]https://www.askci.com/news/chanye/20210902/1111371574689.shtml






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号