三级淋巴结构 (Tertiary lymphoid structures,TLSs) 是出生后在非淋巴组织中形成的免疫细胞的组织聚集体。TLSs 不是在生理条件下发现的,而是发生在慢性炎症的背景下,如在自身免疫性疾病、慢性感染和癌症中。除少数例外情况外,肿瘤中 TLS 的存在与免疫治疗后更好的预后和临床结局相关,尽管推测其有非常重要作用,但癌症中 TLS 形成的驱动因素以及这些结构对肿瘤内免疫应答的贡献仍不完全清楚。TLSs在解剖学上类似于次级淋巴器官 (SLO),最初假定其形成在很大程度上是由相同的刺激诱导的,现有证据表明 TLSs 对肿瘤特异性免疫反应是有贡献的。TLSs在癌症中的预后和预测价值以及作为潜在的治疗靶点具有重要意义。
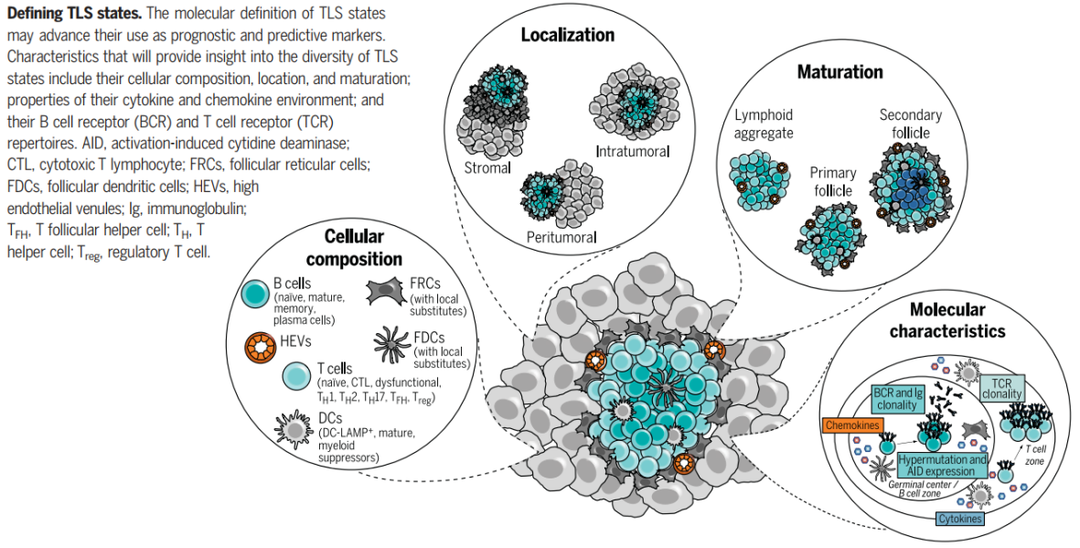
图1. 肿瘤三级淋巴结构
癌症TLSs中免疫浸润的组成
与肿瘤浸润 T 细胞相似,免疫浸润B细胞存在高度组织化的TLSs,类似于淋巴结,TLS包括明确分界的含有CD21 + 滤泡树突状细胞 (FDC) 的 B 细胞滤泡和含有常规树突状细胞和高内皮小静脉 (HEV) 的相邻 T 细胞区(图3)。在一些 TLS 中,B细胞滤泡含有特征(和标志物)定义的生发中心,如活化的FDC(CD21、CD23)、发生增殖和体细胞超突变的 B 细胞(Ki67、B细胞淋巴瘤蛋白 (BCL6)、活化诱导的胞苷脱氨酶 (AICDA))、Tfh细胞(CD4、BCL6、诱导性 T 细胞共刺激 (ICOS)、PD-1)、浆母细胞。
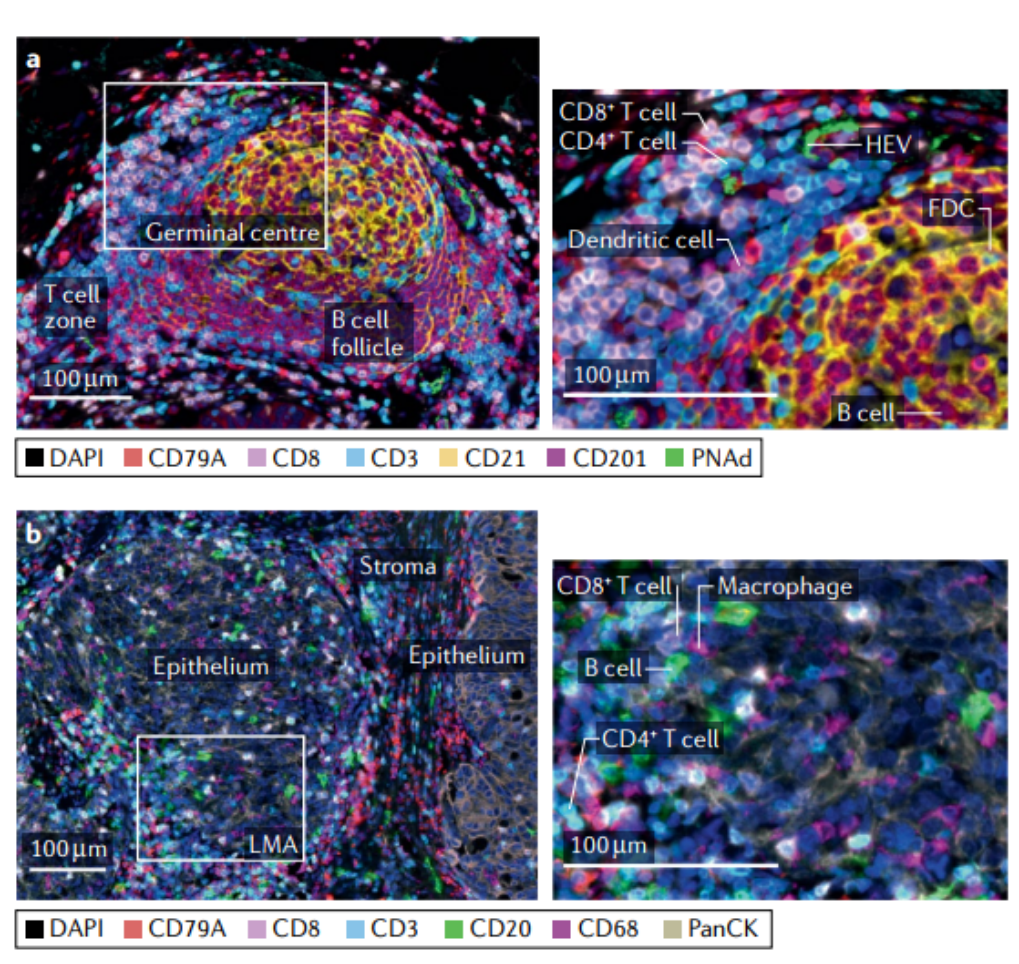

图2. B淋巴细胞浸润区域。
a-d.人卵巢癌(a-c部分)和乳腺髓样癌组织(d部分)的多重免疫荧光染色。
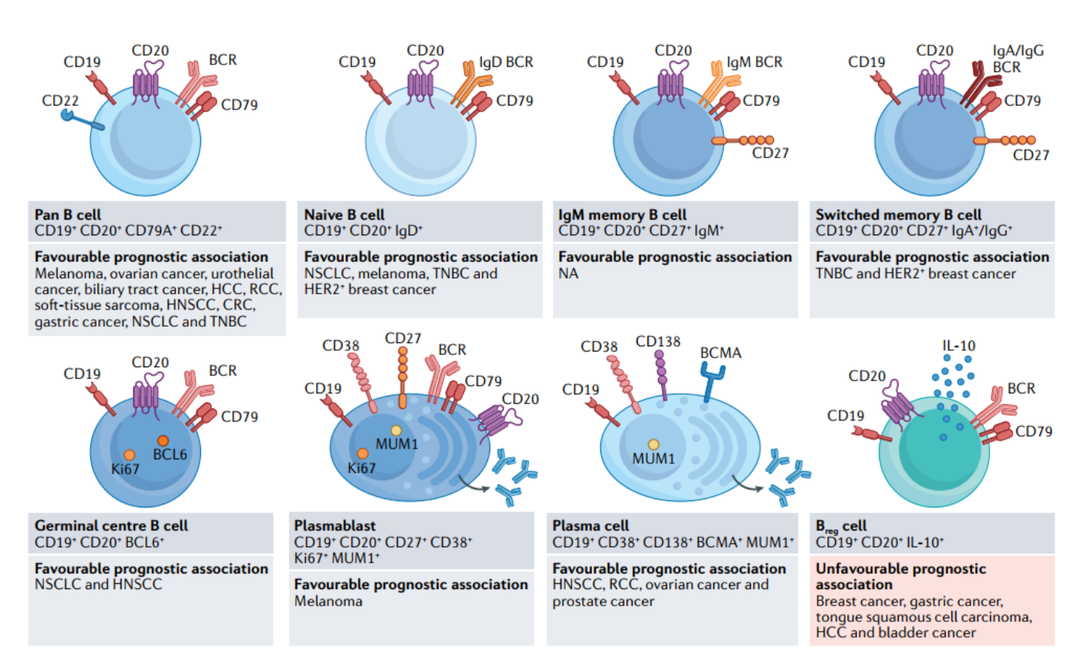
图3. 癌症中的 B 细胞亚型
上方框表示用于鉴定特定 B 细胞亚群的已达成普遍共识的表型标记,以及迄今为止尚未建立共识标记的调节性 B(Breg) 细胞的最小识别特征。下框表示不同癌症中各种 B 细胞亚型报告的预后相关性。BCR,B细胞受体;CRC,结直肠癌;HCC,肝细胞癌;HNSCC,头颈部鳞状细胞癌;NA,不可用;NSCLC,非小细胞肺癌;RCC,肾细胞癌;TNBC,三阴性乳腺癌
TLSs 已在许多癌症类型中报告,如非小细胞肺癌 (NSCLC)、结直肠癌 (CRC)、卵巢癌和黑色素瘤。不同癌症类型之间 TLS 的发生率可能不同。TLS 的特征为CD3+ T细胞包围的CD20+ B细胞内区,与次级淋巴器官 (SLO) 中的淋巴滤泡相似。尽管 TLSs 的具体组成可能不同,但在 T 细胞区室中,CD4 + T滤泡辅助性 (TFH) 细胞通常代表优势亚群,也可能存在CD8+ 细胞毒性性T细胞、CD4+辅助性 T细胞1(Th1) 和调节性T细胞 (Tregs)。
虽然B细胞和T细胞群构成了大部分的 TLS 相关免疫细胞,但 TLSs 也有不同的树突状细胞 (DC) 群,例如CD21 + 滤泡树突状细胞 (FDC),它们是间充质来源,在SLOs或CD83 + 成熟 DC 的生发中心 (GC) 反应过程中记忆 B 细胞的选择中起关键作用,主要定位于 T 细胞区。滤泡可进一步含有分散的CD68 + 巨噬细胞以清除凋亡细胞,与其在 SLO 中的作用相似。致密的基质网络,类似于 SLOs 中滤泡网状细胞 (FRC) 形成的基质网络,将 TLSs 锚定在慢性炎症组织部位。最后,外周淋巴结地址素 (PNAd) 阳性的高内皮小静脉 (HEV) 提供了与 TLSs 相关的特殊脉管系统,被认为介导淋巴细胞募集。
TLS形成的驱动因素
二级淋巴结SLO(包括淋巴结、脾脏、扁桃体、派尔氏结和粘膜相关淋巴组织)位于全身,允许从不同组织采集抗原样本,从而促进诱导适应性免疫应答。在持续慢性炎症的情况下, 产生额外的淋巴组织,导致器官部位形成TLS。这类 TLSs 的发育,类似SLO,特别是淋巴结和派尔氏结,是由一系列高度有序的事件导致的,涉及造血细胞和非淋巴基质细胞之间的相互作用,细胞因子、趋化因子、粘附分子和作为分子组分的存活因子的关键作用。
在胚胎形成早期,SLO的形成是由造血淋巴组织诱导(LTi) 细胞(从胎肝前体分化而来的CD4+CD3-CD45+ 固有淋巴细胞)在淋巴结原基的定植而启动的,其特征是表达 RORgt 和 Id2 转录因子。LTi 细胞的聚集以肿瘤坏死因子 (TNF) 家族成员依赖的方式驱动 SLO 形成的初始步骤,淋巴毒素 a1b2(LTa1b2) 和 TNF在一定程度上发挥了核心作用,在缺乏 LTi 细胞或 LTa1b2 的情况下,不会形成淋巴结和派尔氏结。
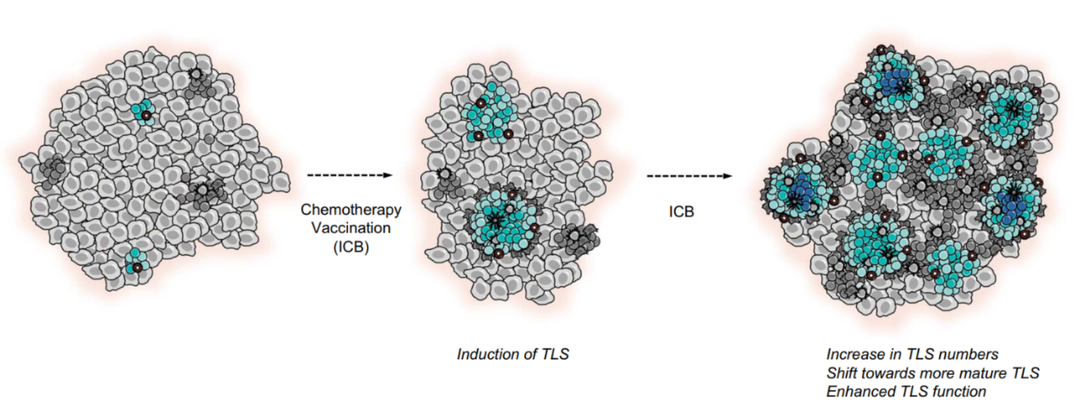
图4. 癌症治疗对 TLS 的潜在影响
LTa1b2 和 TNF 与间充质淋巴组织组织者 (LTo) 细胞上各自的受体 LTbR 和 TNFR1 结合,从而促进血管细胞粘附分子1(VCAM1)、细胞间粘附分子1(ICAM1)、粘膜地址素细胞粘附分1(MAdCAM1)、PNAd等粘附分子的表达,以及产生一组被称为淋巴或稳态趋化因子的趋化因子,包括趋化因子配体19(CCL19)、CCL21和 CXC 趋化因子配体13(CXCL13)。总之,这些分子调节免疫细胞随后募集到淋巴微环境和HEV的血管化。最后,新生淋巴滤泡的分隔通过趋化因子的分离表达实现。
TLS 与 SLO 有明显的解剖学相似性,但在大多数组织中,缺乏周围包膜。这种无包囊形成可能允许其细胞组分直接进入周围组织,但也可能使 TLS 驻留的免疫细胞暴露于发炎微环境中的大分子。
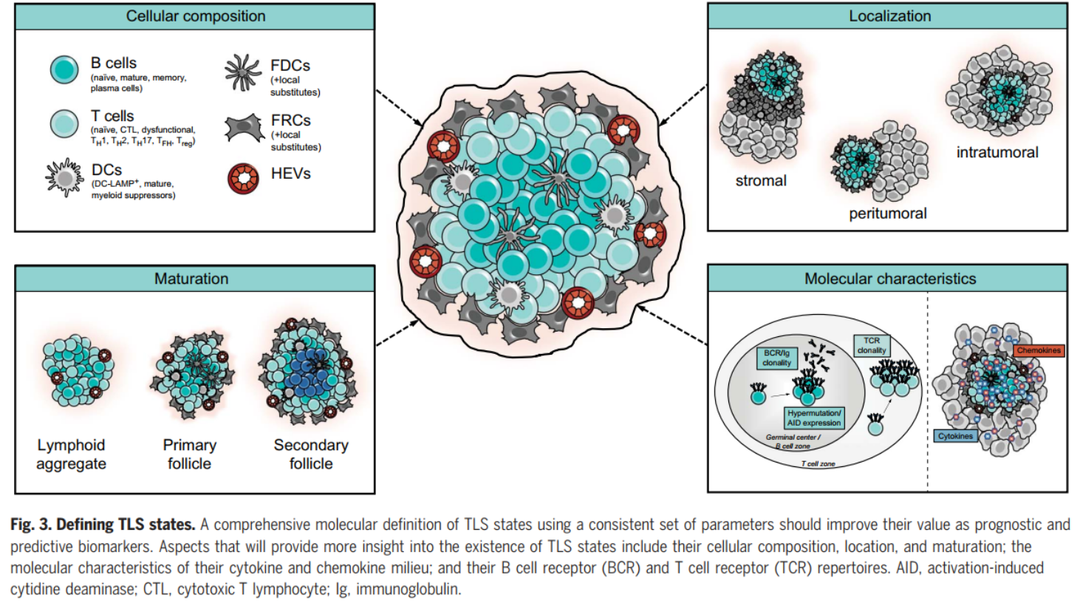
图5. TLS不同的状态
TLSs在肿瘤特异性免疫反应调节中的作用
由于其解剖结构与 SLO 相似,有人认为 TLSs 在炎症组织部位囊括了 SLO 功能。SLO,特别是淋巴结,通过提供一个特殊的小生境,使细胞间接触最大化,从而能够产生适应性免疫应答,促进组织中富含抗原的 APC 和血液中初始淋巴细胞的相遇。越来越多的证据表明,适应性免疫反应也可以在 TLSs 中产生或增强。TLS 中与 B 细胞相关的主要效应功能之一是产生疾病相关抗体,可标记抗原表达细胞的调理素化、补体介导的裂解或抗体介导的细胞毒性。
已发现 TLSs 中 GC 的形成与几种自身免疫性疾病的血清自身抗体浓度、疾病严重程度和器官功能下降相关,包括重症肌无力和甲状腺炎,表明 TLSs 对疾病进展的潜在作用。此外,通过检测活化诱导的胞苷脱氨酶(驱动体细胞超突变和类别转换的酶)和BCL6,提供了 TLSs 中活跃发生克隆增殖、同种型转换和 B 细胞效应物分化的证据。TLSs 中有助于 GC 进入和晚期 B 细胞成熟的转录因子。同样,与黑色素瘤中的其他肿瘤驻留T细胞相比,在 TLSs 内的 T 细胞上观察到活化标志物的表达增加。另一方面,在非肥胖糖尿病小鼠的胰岛中,初始 T 细胞向 TLSs 的募集也有描述。值得注意的是,这种初始 T 细胞确实在原位发生增殖,与局部启动一致。
同样,在发炎的中枢神经系统中,TLSs被发现参与了自身反应性 T 细胞对内源性髓鞘肽反应的局部启动。使用缺乏淋巴结的 LTa 缺陷小鼠获得了 TLSs 在无 SLOs 的情况下可诱导 B 细胞和 T 细胞应答的额外证据。这些小鼠的甲型流感感染导致在病毒清除时诱导iBALT。此外,这些小鼠中 T 细胞和 B 细胞对病毒抗原的应答在性质上与淋巴结中启动的应答相似,但引起的免疫病理较少。在改良的痘苗病毒安卡拉模型中,观察到阻断淋巴细胞从 SLOs 流出后抗原特异性 T 细胞应答的启动。此外,在鼠黑色素瘤模型中,在没有 SLO 的情况下确定了由 TLSs 驱动的肿瘤特异性 T 细胞应答,并导致免疫细胞浸润和肿瘤消退。总的来说,这些数据提供了令人信服的证据表明 TLS 可以在本地复制 SLO 功能。
由于典型的 SLO 已经进化为有效产生抗原特异性适应性免疫应答的位点,人们可能会疑问在发炎组织部位复制淋巴新生过程的价值是什么。由于目前缺乏关于 TLSs 功能的详细信息,可能提出一些模型来解释为什么在慢性炎症条件下,在感染或癌症部位形成三级淋巴结构可能是有以下功能:
① 速度:T和 B 细胞池的局部启动可能导致更快的免疫反应
② 效率:局部淋巴小生境的产生可能会增加疾病相关抗原与罕见的匹配淋巴细胞相遇的可能性,也许能够诱导更强烈或更广泛的免疫反应。
③ 控制:具有与发炎组织部位直接接触的淋巴龛可能提供引导免疫应答的额外机会。
④ 存活:在一些 TLSs 中存在大量功能失调的PD-1high CD8 + T细胞,这是一种与优先肿瘤反应性相关的表型,这与 TLSs 不仅对诱导而且对维持免疫反应都很重要的模型是一致的。
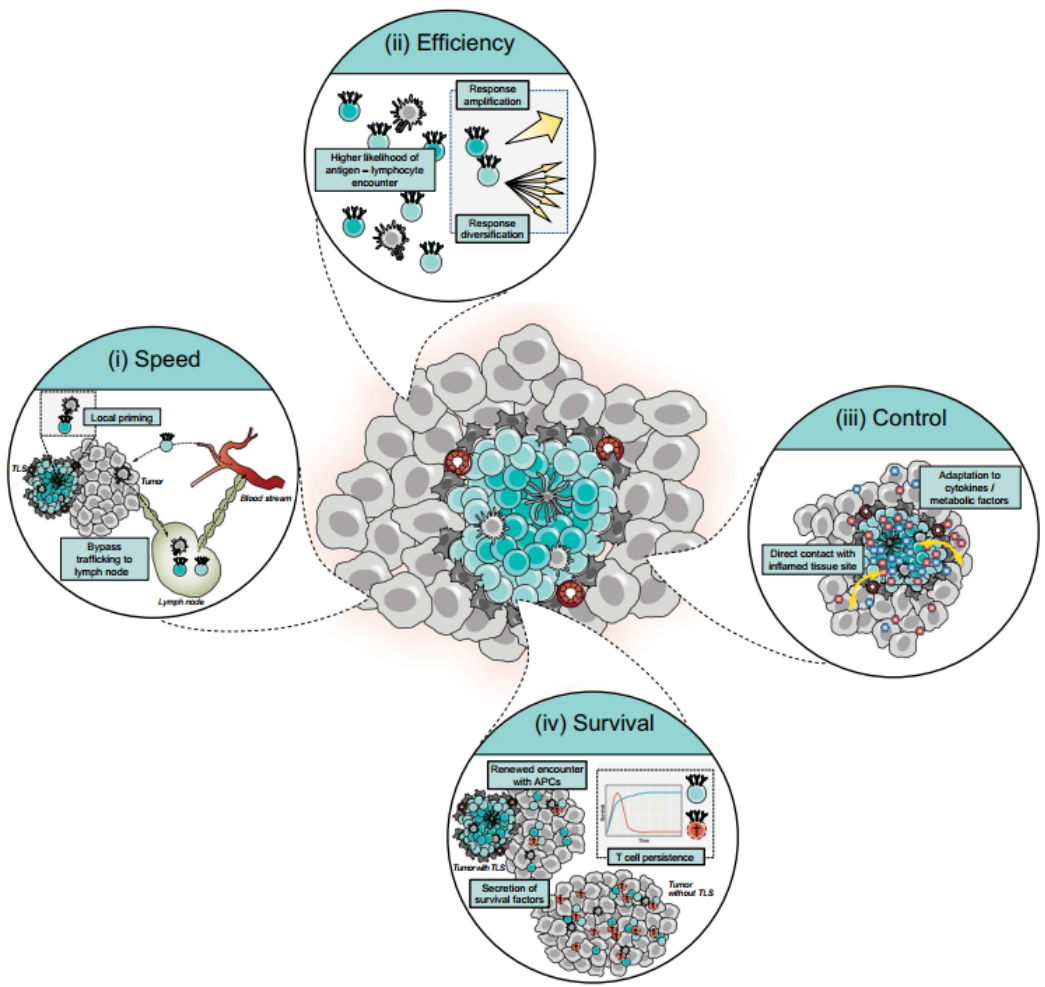
图6. TLSs 潜在的抗肿瘤作用
TLSs的诊断和预后价值
与许多癌症类型的良好预后相关,TLSs的预后价值通常与 TNM 分期无关,例如,记录在肺癌、结直肠癌和胰腺癌中。TLS 密度以及其成分的存在,如 TFH 细胞、滤泡 B 细胞、DC-LAMP + 成熟 DC 和HEV,已被证明与许多不同肿瘤类型的更好生存率相关。此外,与 TLSs 相关的多个基因表达标签显示出积极的预后价值,包括卵巢癌中的浆细胞标签,头颈部鳞状细胞癌中的 TFH 标签,以及与淋巴趋化因子相关的各种基因标签(包括CCL5,CXCL9,CXCL10,和CXCL13)在黑色素瘤和乳腺癌中的作用。此外,肿瘤中 TLSs 的存在通常伴随免疫浸润的普遍增加,例如,在人类 NSCLC 和三阴性乳腺癌中最后与单独的CD8 + T细胞浸润相比,TLSs和活跃的肿瘤内CD8 + T细胞浸润的组合与更好的预后相关,这一观察结果已被报道证实。
在某些情况下TLS 鉴定的标记物方面存在差异,有研究表明癌症类型之间以及患者之间存在 TLS 异质性,在趋化因子转基因小鼠模型中的工作为这一观点提供了合理的机制支持。假设 TLS 成熟状态或位置的异质性影响其预后价值。大多数研究报告了存在瘤周TLS,但在HCC、生殖细胞肿瘤和肾细胞癌肺转移中描述了瘤内TLS。在 HCC 中,与瘤内 TLSs 相比,瘤周 TLSs 的存在与癌症复发风险较高和不良结局相关。然而,在大多数癌症中,TLSs的肿瘤周围或肿瘤内位置与预后之间没有明确的相关性,可以推测,某些亚型的瘤周 TLSs 与疾病预后的相关性可能不同。
最近的一些研究也为 TLS 对 ICB 反应的预测价值提供了证据,有研究证明黑色素瘤、肾细胞癌、软组织肉瘤和尿路上皮癌治疗前活检中存在 TLS 和活跃 B 细胞浸润与 PD-1 或 PD-1 联合细胞毒性 T 淋巴细胞相关蛋白 4(CTLA-4) 阻断的反应相关。同样,许多 TLS 成分,包括记忆样 B 细胞和浆母细胞样细胞,在黑色素瘤 ICB 应答者的治疗前活检中富集。此外,主要位于 TLSs 内的 PD-1 高表达CD8 + T细胞的存在可预测晚期 NSCLC 对 PD-1 阻断的反应。有趣的是,TLS丰度与免疫细胞上的程序性细胞死亡配体-1(PD-L1) 表达相关,但与肿瘤细胞上的程序性细胞死亡配体-1(PD-L1) 表达无关。在小鼠中,导致 TLSs 诱导的联合治疗在检查点阻断抵抗的肿瘤模型中也使肿瘤对 ICB 敏感,并导致效应和记忆 T 细胞的产生,表明 TLSs 或直接促进 ICB 反应,可以推测 ICB 不仅增强 TLS 形成,而且增强 TLS 功能。

图7. TLSs可预测免疫检查点抑制剂治疗的癌症患者的效果
TLS的治疗价值
基于TLS 与疾病之间的相关性,TLS可形成一种有吸引力的治疗策略,已在小鼠模型中证实了其可行性。针对于TLSs的靶向治疗的概念。此外,在乳腺癌和神经内分泌胰腺癌小鼠模型中获得了 TLSs 可被治疗诱导并与肿瘤控制相关的证据,其中 PD-L1 阻断与抗血管生成疗法联合导致肿瘤血管转化为HEV,随后形成TLS。
对于T细胞状态的研究帮助该人们更好地理解它们在癌症控制中的作用一样,对TLS状态的研究可以提高它们作为预后和预测标志物的价值,更充分地了解 TLS 功能及其在自身免疫中的潜在作用将有助于了解其作为治疗靶点的价值。
百奥赛图病理诊断/病理分析/毒理检测平台
百奥赛图药理药效部具备优质的病理诊断/病理分析/毒理检测能力。利用全自动血常规,血生化分析仪;通过全自动高通量的组织切片和组织芯片制备技术,结合HE、IHC、IF、多色免疫荧光染色分析和HALO人工智能数据分析系统等,进行原位病理诊断分析、非临床安全性研究和原位组织微环境biomarker研究。为探索药物药效和毒理作用机制,以及支持临床转化研究等方向奠定了坚实的基础。
检测方法

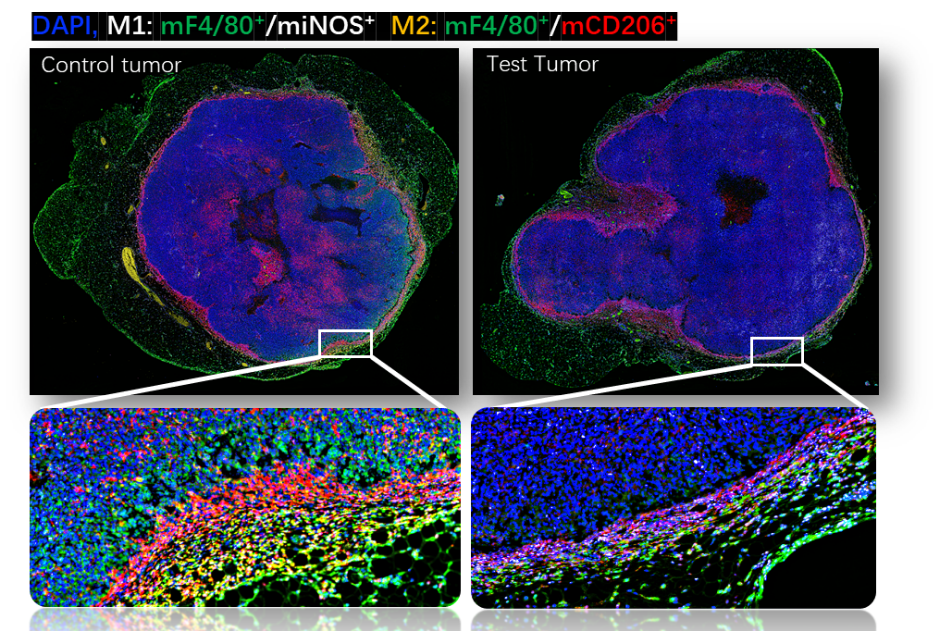
01、组织原位多色免疫荧光(IF)
利用TSA(Tyramide signal amplification)技术,可以实现多色荧光的稳定共染,百奥赛图病理平台采用Akoya Vectra Polaris全自动定量病理成像系统,可实现对全组织切片进行多色(七色六标)荧光定量分析,可用于肿瘤微环境结构分析,免疫细胞浸润评价,免疫细胞组织分布统计与蛋白共表达评估等。
组织原位多色免疫荧光(IF)

Akoya Polaris
02、组织芯片TMA技术
利用组织微阵列(tissue microarrays),也称组织芯片(tissue chip)技术,将数十个上百个小组织排列在某一载体上。高通量获得组织大量信息,大幅度提高效率。多组织在同一条件进行处理后,实验条件均一,保证实验质量同时,大大缩减研究费用。TMA技术可进行IHC染色,免疫荧光共染。用于多器官蛋白表达分析,实验组与对照组的药效评估,蛋白表达水平/共表达的批量统计。

组织芯片示意图
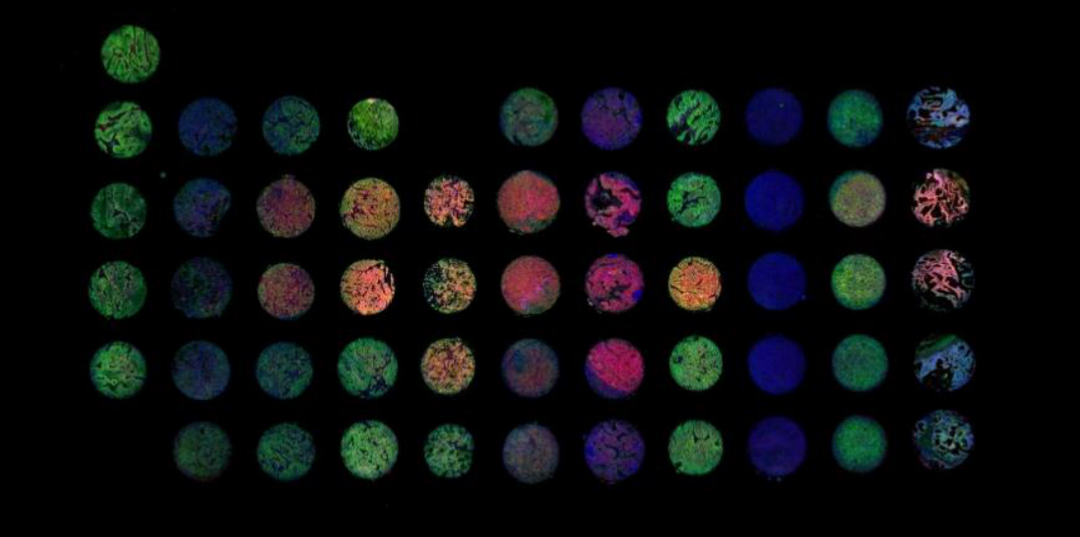
TMA免疫荧光共染示意图

TMA的IHC染色示意图
03、Halo全自动全片AI分析系统

04、硬件平台


更多百奥赛图药理药效部相关技术及服务资料,感兴趣的老师欢迎随时联系我们。
参考资料:
1. Tumour-infiltrating B cells: immunological mechanisms, clinical impact and therapeutic opportunities. Nature review| cancer 2022
2. Tertiary lymphoid structures in cancer ,Science 375, 39 (2022)
3. Mature tertiary lymphoid structures predict immune checkpoint inhibitor efficacy in solid tumors independently of PD-L1 expression. Nature cancer 2021
4. Tertiary lymphoid structures in the era of cancer immunotherapy. Nature reviews | Cancer 2019
5. B cells and tertiary lymphoid structures as determinants of tumour immune contexture and clinical outcome. Nature reviews | Clinical Oncology 2022






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号