双特异性抗体(Bispecific Antibody, BsAb)能够同时靶向两个表位,在治疗效果和安全性上较单抗药物具备一定优势,被认为是颇具潜力的新一代免疫治疗药物。目前全球有近400家企业和机构正在进行双抗药物的临床前及临床开发,根据Nature Reviews Drug Discovery发表文章预测,2027年肿瘤双抗药物市场销售额将达37亿美元,给大家描绘了一个充满前景的未来。
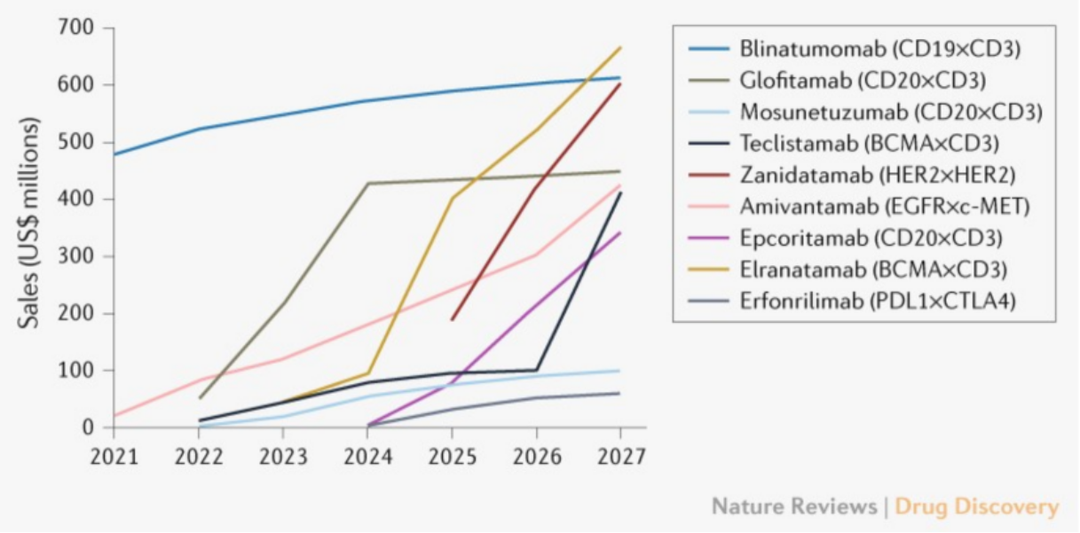
图1. 部分抗肿瘤双抗药物的全球销售额预测[1]
BsAb在自然界并不存在,是一种人工构建的抗体,其形式可以按照Fc的存在与否分为IgG-like和非IgG-like两种。IgG-like形式分子量较大,具有Fc区域,可以执行Fc介导的效应功能,半衰期较非IgG-like形式的更长,纯化、溶解度和稳定性更高。非IgG-like形式的双抗主要发挥更多的抗原结合能力,由于没有Fc区域其循环动力学较低,但具有更好的组织穿透能力、较低的免疫原性和较低的先天免疫系统的非特异性激活。
重轻链错配是常见的IgG-like双抗开发挑战之一,同时也涌现了众多的技术平台解决相应的问题,包括knobs-into-holes (KIH)、CrossMab平台、DVD-ig平台、共同轻链小鼠等。KIH是利用基因工程技术对一条重链的CH3结构域进行突变,形成Knob结构,另一条重链CH3突变形成Hole,根据空间互补及疏水作用引导形成异源二聚体,并添加链间二硫键减少同源二聚体杂质,可以有效防止重链错配;但是KIH也会存在轻链错配的问题,可以采用共同轻链的方式解决,如Regeneron的Common light chain mouse和百奥赛图的RenLite小鼠,能够产生自带共同轻链的全人抗体,结合KIH有效避免双抗重轻链错配。
CrossMab新技术的出现进一步减少了重/轻链间错配的问题。这是在KIH基础上,通过对一个抗体的重链和轻链进行区域互换达到防止错配的目的。总共有三种方法,包括基于 CH1 与CL的互换(CrossMab CH1-CL)、VH与VL (CrossMab VH-VL)或VL-CL与VH-CH1 (CrossMab Fab)的互换。DVD-Ig是一种双特异性四价IgG-like分子,将一个抗体的四个可变结构域连接到第二个抗体的重链和轻链的N末端,这要求在四个抗原结合结构域之间没有显著的空间位阻,限制靶点适用性。
非 IgG 样形式包括基于scFv的形式、纳米抗体、对接锁定 (DNL) 方法和其他多价分子。通常,基于scFv的格式包含 scFv、单域 Abs (sdAbs)、串联 scFv 分子 (ta-scFvs)、双抗体、串联双抗体 (TandAbs) 和双亲和重定位分子 (DART)等。目前已经产生了100多种BsAb形式,多种功能形式加速了药物从临床前到临床的开发。
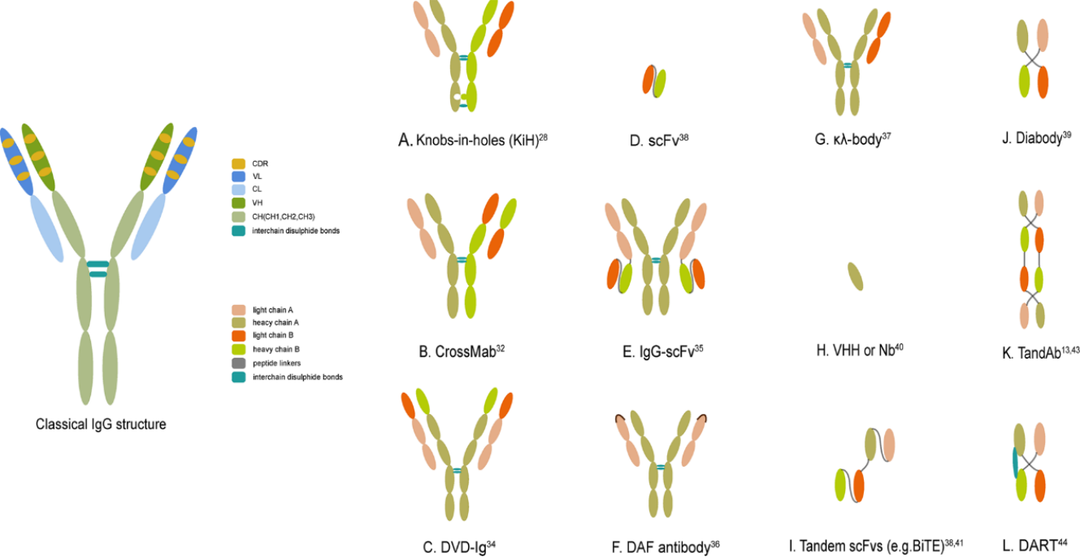
图2. 代表性的双抗结构形式[2]
BsAbs在肿瘤治疗的首次应用是将T细胞重新定向至肿瘤细胞上,通过识别肿瘤表面相关抗原(TAA)介导T细胞杀伤,也就是起到了免疫细胞衔接的作用。具有代表性的BiTE(Bispecific T-cell engagers)是2014年Amgen获批上市CD3×CD19双抗-Blinatumomab,适应症为急性淋巴细胞白血病(ALL)。但由于没有Fc区域,其血清半衰期较短,需要持续静脉输注以达到治疗性血清水平。Blinatumomab的上市推动了一系列CD3双抗的研发,另一端的TAA靶点包括血液肿瘤相关的CD19、CD20、BCMA、CD33、CD123和CLEC12A等,与实体瘤相关的CLDN18.2, CEA, EpCAM, HER2, PSMA, pCadherin, GPC3, GPA33等。
传统的TAA抗原多数表达在细胞表面,而胞内抗原也是一类肿瘤治疗的理想靶点,肿瘤细胞上MHC分子呈递的新抗原肽能够被类TCR(TCRm)抗体所识别,BsAb的另一端靶向CD3募集T细胞实现对肿瘤细胞的杀伤。2022年1月,T细胞受体(TCR)疗法Kimmtrak®(tebentafusp)获美国FDA批准上市,用于治疗HLA-A*02:01阳性、不可切除或转移性的葡萄膜黑色素瘤成人患者。这也是首款获批的TCR疗法,对于靶向实体瘤胞内抗原的药物开发是一个重要的突破。
T细胞衔接器双抗也存在一定开发挑战,可能会存在非靶标依赖的T细胞激活,进而产生细胞因子释放等副作用。如第一代的T细胞衔接器-2009 年获批的Catumaxomab(CD3E×EpCAM双抗)用于腹腔内治疗恶性腹水,然而由于其严重的不良事件与销售不佳等商业原因最终该药物退出市场。这些不良事件归因于该药Fc结构域介导的FcγR激活,导致细胞因子释放综合征(CRS)和T细胞介导的肝毒性。
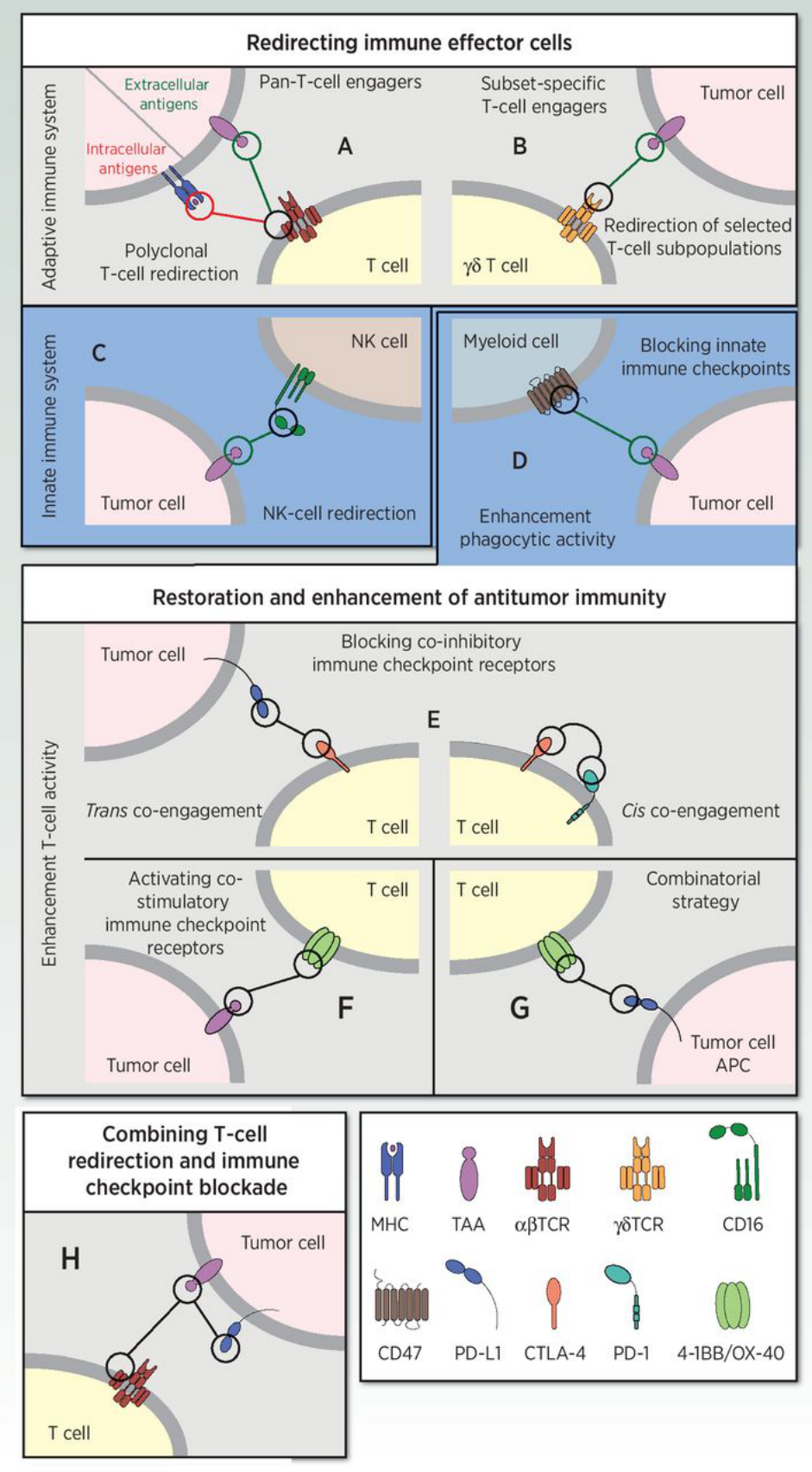
图3. 免疫细胞衔接器类型[3]
作为抗肿瘤先天免疫的一线战士,NK细胞在过去几十年中也引起了广泛关注。多种研究表明,受损或缺乏的NK细胞功能与更高的肿瘤发生、进展和转移风险密切相关。值得注意的是,实体瘤中较高比例的NK细胞浸润与更好的临床结果相关,这已在结直肠癌、乳腺癌、透明细胞肾癌、头颈癌和咽癌中得到证实。因此将NK细胞重定向到癌细胞的“双特异性杀伤细胞衔接器”(BiKE)或“三特异性杀伤细胞衔接器”(TriKE)也成为双/多抗药物研发的新热门方向。
在2022AACR年会上,Affimed公布了CD30×CD16A双抗AFM13与脐血来源的同种异体NK细胞预复合后治疗CD30+复发或难治性霍奇金/非霍奇金淋巴瘤患者的I/II期临床试验结果,总缓解率89%,完全缓解率达62%,令人惊艳。此外,GT Biopharma公司正在研发一款三特异性抗体GTB-3550。它的两臂分别靶向CD33和CD16A,并且还与修饰的人IL-15连接,形成一个TRiKE (Trispecific Killer Engager)结构,与双抗相比能够促进NK细胞活性,有助于维持、延长和增强抗体效应。

图4. AFM13药物结构(来源:Affimed)
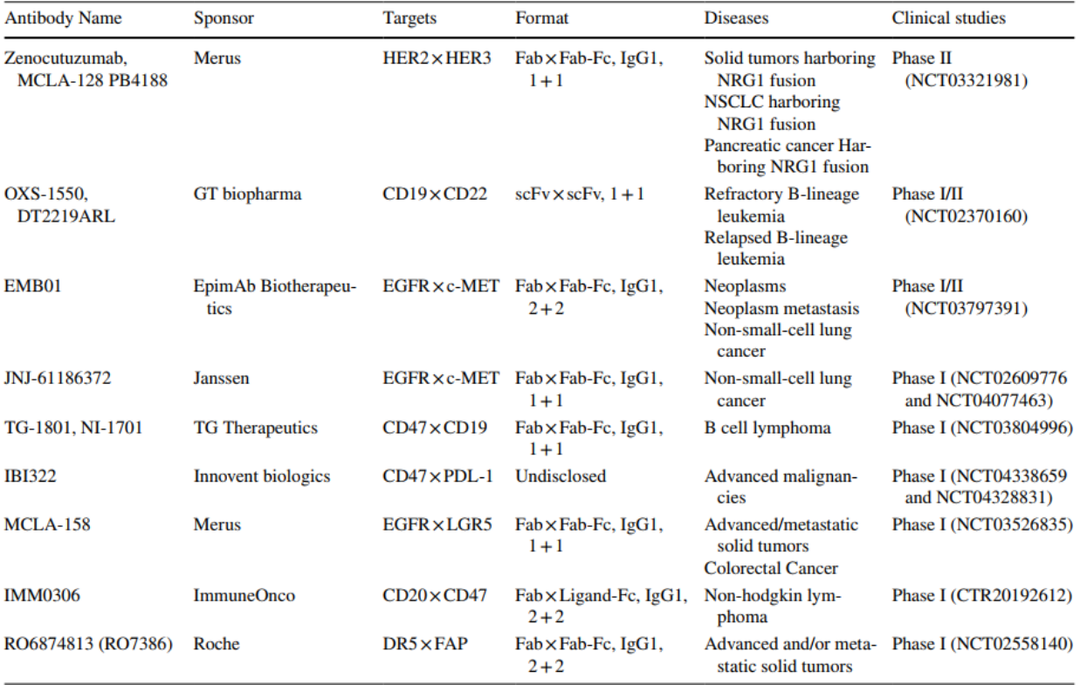
BsAb也可以同时靶向两种TAA/TSA靶点,增加药物靶向特异性,同时阻断两个肿瘤相关的信号通路,一定程度避免由于免疫耐受引起的耐药性。强生开发的Amivantamab(Rybrevant®)是首款EGFR×c-Met双抗,2021年获FDA批准上市,用于含铂化疗进展后的EGFR外显子20插入突变非小细胞肺癌治疗,客观缓解率为40%。国内岸迈生物、贝达药业EGFR×c-Met双抗处于临床阶段。2022年4月26日,Nature Cancer发表了Merus公司的MCLA-158最新临床前研究结果,MCLA-158是一款靶向EGFR和癌症干细胞新抗原LGR5的双抗,临床前研究显示其抗肿瘤活性优于EGFR单抗,并且可以高效的介导EGFR內吞和降解,是一款FIC潜力药物,目前在临床I期阶段[5,6]。
表1. 部分处于临床阶段的靶向双TAA双抗药物[7]
免疫检查点单抗是目前研究最充分的一类抗体药物,但由于单抗治疗有效性有一定局限,针对双免疫检查点/免疫调节剂的双抗或能改善临床获益,作用方向包括阻断共抑制受体,激活共刺激受体,同时靶向共刺激和共抑制受体,靶向肿瘤微环境等。PD-1/PD-L1是BsAb靶向的经典靶点之一,CTLA4、OX40、TIM3、TIGIT、CD47、LAG3等都是在研双抗的主要靶点。
尽管CTLA4单抗药物ipilimumab已经在临床上有不错的治疗效果,但由于不良反应其使用剂量受到限制。PD-1×CTLA-4双抗在有效性和安全性上都有一定优势,国内外药企均有布局,康方生物卡度尼利单抗AK104进展最快在III期临床阶段并已向NMPA递交用于治疗复发/转移宫颈癌的新药上市申请。靶向肿瘤微环境双抗也在逐渐增多,包括VEGF、TGFβ等。TGF-β是转化生长因子,促进肿瘤细胞增殖,TGF-β升高促进未成熟T细胞向Treg分化导致肿瘤免疫逃逸。TGF-β与 PD-L1 具有潜在协同性,恒瑞医药PD-L1×TGF-β双抗SHR-1701用于治疗胰腺癌、非小细胞肺癌适应症处于临床 II期阶段。
表2. 部分临床阶段双免疫调节剂双抗
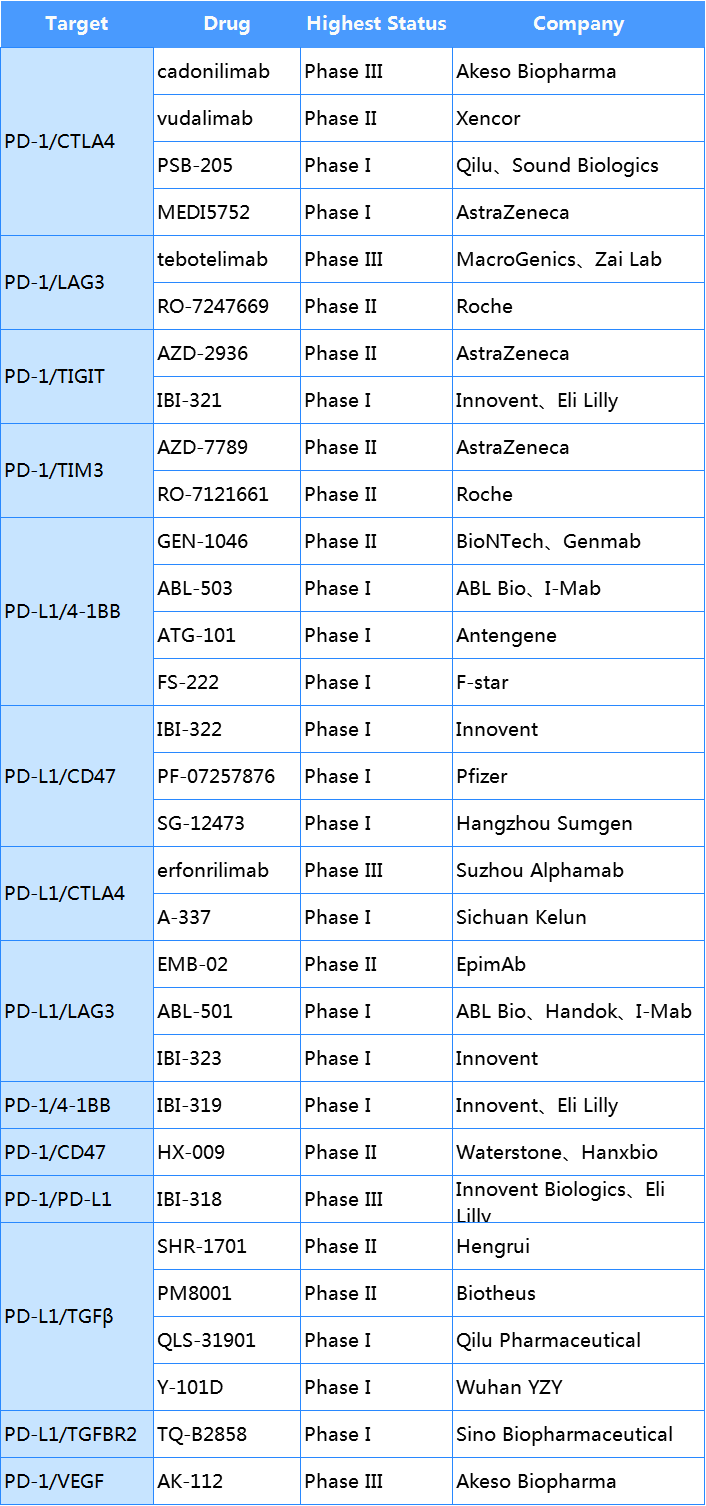
(来源:科睿唯安,公开资料)
BsAb单药治疗如果受到限制,联合治疗策略可以作为一个补充。据观察,部分BsAb临床治疗效果不足可能部分归因于TME中的免疫抑制。ABL Bio开发的B7-H3×4-1BB双抗在临床前研究中发现与PD-1抗体联用可以进一步增强抗肿瘤活性,改善存活率,起到2+1的协同效应。安进在小鼠模型中研究发现,CD33×CD3 BiTE (AMG330) 会导致肿瘤细胞中PD-1上调,并显示T细胞介导的肿瘤细胞裂解显著受损。阻断PD-1/PD-L1 相互作用,增强了AMG330的再敏化,增强其介导的细胞裂解。双抗药物联合化疗,联合细胞治疗等策略都使得免疫治疗的潜力被充分挖掘。
随着双抗药物的爆发,监管机构出台系列政策指导双抗药物开发,2021年5月FDA发布《双特异性抗体研发指南》,2022年4月11日CDE发布《双特异性抗体类抗肿瘤药物临床研究技术指导原则》征求意见稿[8]。意见稿中指出,双抗研发项目的立项需要针对单抗产品的不足或缺陷,或者已经开发两个单抗的联用证明了协同作用,希望通过双抗进一步结构优化,真正面向未被满足的临床需求,考虑靶点选择、结构设计和工艺质量等关键考量因素。临床方面,在安全剂量范围内可以选用不少于 2 个候选给药方案进行扩展的剂量探索研究,为确定后续研究的最佳推荐剂量和给药方案提供重要依据;在采用对照研究设计时,原则上应选择最优(即反映临床实践中目标患者的最佳治疗选择)的标准治疗(standard of care,SOC)为对照。
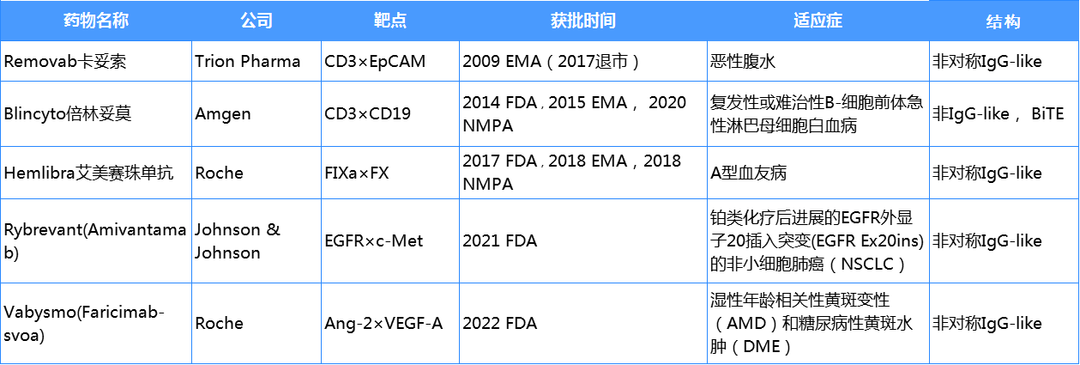
表3. 已上市双抗药物
根据弗罗斯特沙利文的数据,预计2030年中国的双抗市场达到108亿美元。我国双抗药物开发正在大步赶超国际制药企业,同时小跑进入了内卷时代,双抗药物研发相对复杂,考量因素较多,靶点选择、结构设计、机制研究、临床前模型及研究、质量工艺、临床方案等缺一不可。
参考资料:
[1] Arman Esfandiari, Sorcha Cassidy & Rachel M. Webster. Bispecific antibodies in oncology. Nature Reviews Drug Discovery,2022.
[2] Li, H., Er Saw, P. & Song, E. Challenges and strategies for next-generation bispecific antibody-based antitumor therapeutics. Cell Mol Immunol 17, 451–461 (2020).
[3] Belén Blanco, Carmen Domínguez-Alonso, Luis Alvarez-Vallina; Bispecific Immunomodulatory Antibodies for Cancer Immunotherapy. Clin Cancer Res 15 October 2021; 27 (20): 5457–5464.
[4] Dahlén E, Veitonmäki N, Norlén P. Bispecific antibodies in cancer immunotherapy. Therapeutic Advances in Vaccines and Immunotherapy. February 2018:3-17.
[5] 医药笔记丨靶向癌症干细胞抗原:新型双抗极具潜力
[6] Herpers, B., Eppink, B., James, M.I. et al. Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors. Nat Cancer 3, 418–436 (2022).
[7] Huang, S., van Duijnhoven, S.M.J., Sijts, A.J.A.M. et al. Bispecific antibodies targeting dual tumor-associated antigens in cancer therapy. J Cancer Res Clin Oncol 146, 3111–3122 (2020).
[8] CDE:《双特异性抗体类抗肿瘤药物临床研发技术指导原则(征求意见稿)》






 010-56967680
010-56967680 info@bbctg.com.cn
info@bbctg.com.cn 苏公网安备:32068402320845号
苏公网安备:32068402320845号